Introduzione
Hai studiato le principali classi dei composti della chimica organica, ma proprio non riesci a capire la nomenclatura? E, in particolare, non sai come dare il nome a molecole complesse dove più gruppi funzionali sono presenti?
Non preoccuparti questo è normale, perché la maggior parte dei libri di chimica organica tratta la nomenclatura a compartimenti stagni, ossia senza un reale collegamento tra una classe di composti e un’altra. Questo è fatto di proposito perché trattare la nomenclatura in modo organico sarebbe troppo complicato.
Tuttavia, tale abitudine dei libri provoca profonda insicurezza negli studenti che si trascineranno il problema della nomenclatura anche più avanti nella loro carriera.
Se vuoi, dunque, sentirti più a tuo agio con la nomenclatura organica e potenziare le tue capacità in tale ambito, questo articolo fa per te.
Infatti, troverai di seguito un riassunto dei concetti base per dare il nome a qualsiasi composto organico, seguendo delle regole sistematiche che abbiamo cercato di schematizzare.
I concetti qui descritti sono stati presi direttamente dal Libro Blu (Blue Book) del 2013 della International Union of Pure and Applied Chemistry (IUPAC).[1], [2] La IUPAC è una commissione di esperti che si è più volte riunita nel corso degli anni per pubblicare le linee guida di una corretta nomenclatura dei composti di chimica. Il Libro Blu è relativo alla chimica organica, mentre altri libri identificati da altri colori, sono relativi a altre branche della chimica; ad esempio il Libro Rosso è per la nomenclatura dei composti inorganici, mentre quello viola è dedicato ai polimeri e così via.
Senza perderci in ulteriori chiacchere, scopri di seguito come dare il nome a qualsiasi composto organico.
Tipi di nomenclatura
La nomenclatura in chimica organica è complicata dalla presenza di più modalità di assegnare i nomi ai composti. Infatti, i primi nomi dati ai composti organici non erano legati alla struttura della molecola, ma venivano assegnati dai chimici in base alla fantasia del momento. Oggi un po’ di ordine è stato fatto dalla IUPAC che ha sviluppato
la nomenclatura sistematica, ossia una nomenclatura inequivocabile che fornisce il nome di un composto guardando alla sua struttura
In questo modo sarà possibile passare dal nome alla struttura e dalla struttura al nome senza equivoci.
Tuttavia, anche la nomenclatura sistematica è complicata dalla presenza di più modalità di dare il nome alle strutture; infatti alla nomenclatura detta sostitutiva, si può affiancare quella delle classi funzionali. O ancora ci possono essere dei nomi comuni che sono stati mantenuti per via del loro uso troppo prolungato da parte dei chimici.
In nostro aiuto, però, c’è il fatto che la nomenclatura maggiormente usata è quella sostitutiva, quindi in questo articolo ci concentreremo su questa. Mentre la nomenclatura dei gruppi funzionali la vedremo applicata solo a certe classi di sostanze come eteri, esteri e alogenuri acidi.

Vuoi avere le informazioni di questo articolo con te? Puoi scaricare questo articolo completo di Figure e Tabelle, in formato pdf o docx. Lo trovi qui.
Nomenclatura sostitutiva
Un nome in qualsiasi lingua è almeno composto da una radice, che fornisce informazioni sul significato e da una desinenza, ossia la parte finale della parola, che in italiano ne determina il plurale o singolare e il femminile o maschile. A questa parola base si possono, poi, aggiungere dei prefissi (prima della radice) o dei suffissi (dopo la radice) per modificare il significato base della radice (vedi schema in basso, Schema 1).
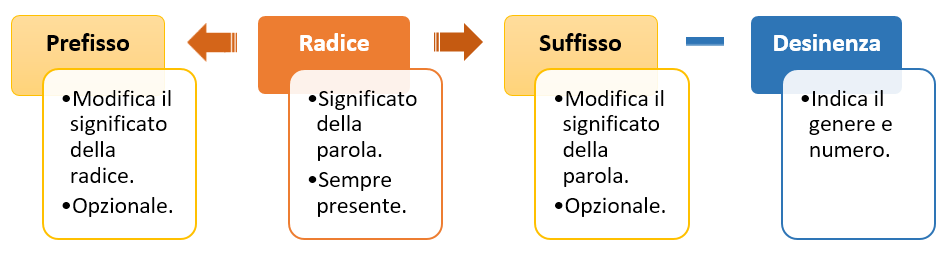
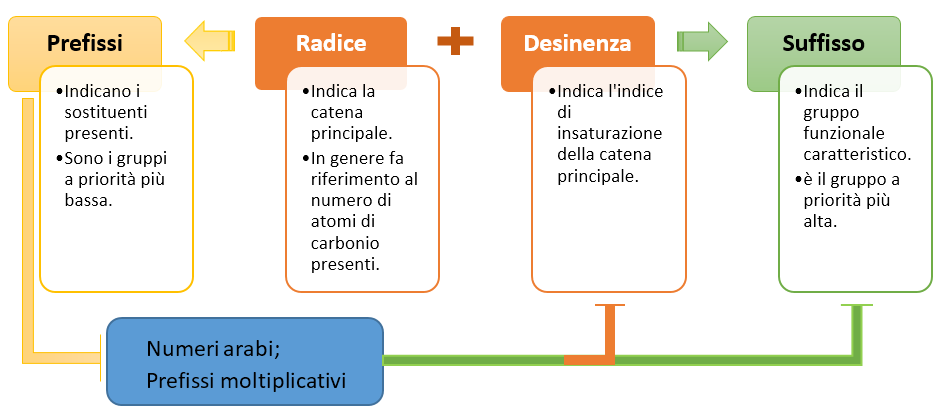
In chimica organica il nome è strutturato in modo simile. Nella nomenclatura sostitutiva infatti il nome è formato da:
- Una radice che fa riferimento alla struttura principale (parent structure). La struttura principale è la parte della molecola che contiene uno o più atomi di carbonio legati a idrogeni in una struttura non-ramificata. In genere la struttura principale è data dalla catena idrocarburica lineare più lunga presente nella molecola; quindi fa di solito riferimento al numero di atomi di carbonio presenti sulla catena (es, met- et- prop- etc.). Tuttavia vedremo più avanti come trovare la struttura principale;
- Una desinenza da agganciare direttamente alla radice e che indica l’indice di insaturazione della struttura principale. Le desinenze sono -ano per indicare una catena principale satura, -ene per la presenza di un legame doppio e –ino per la presenza di un triplo legame.
- Un suffisso che indica il gruppo funzionale caratteristico della molecola. Questo gruppo è facilmente trovabile consultando le tabelle sulla priorità dei gruppi, infatti corrisponde al gruppo a priorità maggiore.
- Un prefisso che indica i sostituenti a priorità inferiore presenti sulla catena principale.
- Numeri arabi che indicano la posizione dei sostituenti e delle insaturazioni sulla catena principale. I numeri si devono mettere direttamente vicini alla parte del nome a cui si riferiscono.
- Prefissi moltiplicativi, da usare quando due o più frammenti uguali si ripetono nella molecola.
Puoi vedere riassunta la struttura di un nome in chimica organica nello schema seguente (Schema 2).
Inoltre, di seguito trovi un esempio di nomenclatura di un composto organico.
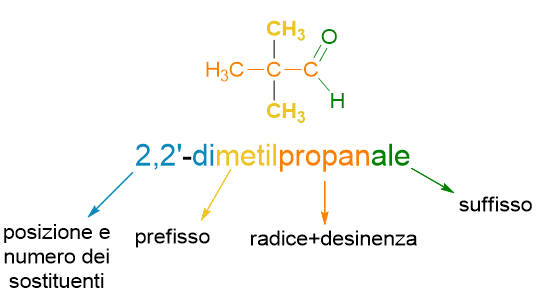
Se non sai come si ottiene il nome di sopra, non preoccuparti perché lo vedremo nei paragrafi di seguito. Per ora ti basti sapere che la struttura di un nome in chimica organica è fatta da vari blocchi, come i vagoni di un treno; il blocco principale, il vagone locomotiva del nostro treno, è quello della radice che individua la catena principale, che nell’esempio di sopra è prop- ossia 3 atomi di carbonio.
Vediamo nei paragrafi seguenti ognuno di questi blocchi e come metterli insieme.
Radice e desinenza
La radice identifica il nome della catena principale e in genere corrisponde al numero di atomi di carbonio della catena più lunga. Nella Tabella 1, che segue, puoi vedere le radici che si usano per indicare un numero di atomi di carbonio che va da 1 a 100. I primi quattro nomi, met– (1 atomo di C), et– (2 atomi di C), prop– (3 atomi di C), but– (4 atomi di C) sono comuni e quindi da imparare a memoria. I restanti nomi invece sono ricavati dai prefissi numerali greci e quindi facilmente ricordabili (es. pent– indica 5 atomi di carbonio, es– 6 atomi di carbonio e così via).
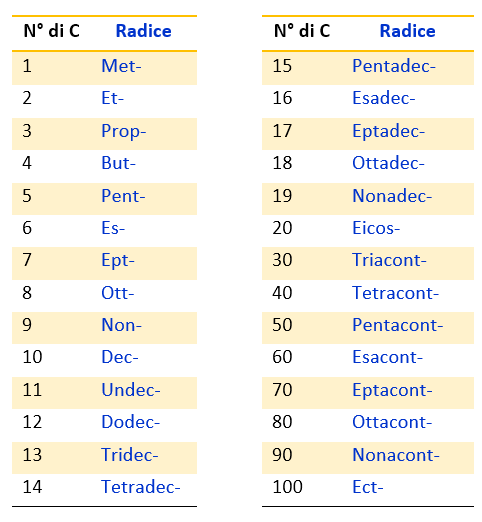
La radice è seguita dalla desinenza che indica l’indice di insaturazione nella catena principale. Nella Tabella 2, che segue, sono elencate le desinenze da usare a seconda dei legami presenti nella molecola.

Con il semplice concetto di Radice+Desinenza, possiamo già dare il nome a un’ampia classe di composti, come gli alcani, gli alcheni, gli alchini, composti aromatici ed eterociclici. Vediamoli subito di seguito.
Nomi di alcani, cicloalcani, alcheni e alchini
Gli alcani sono molecole caratterizzate dalla presenza di una catena principale satura. Come si vede dalla Tabella 2, la presenza di soli legami singoli, si denota con la desinenza –ano. Quindi, il nome agli alcani si dà semplicemente mettendo insieme la radice, che indica il numero di atomi di carbonio presenti (Tabella 1), + la desinenza -ano. Infatti i primi cinque alcani avranno i seguenti nomi:
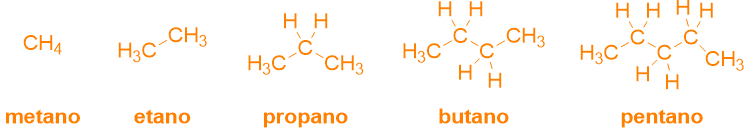
Nel caso di queste molecole semplici la nomenclatura è già conclusa e non c’è bisogno di andare a cercare suffissi o prefissi, perché queste molecole non contengono altri sostituenti o gruppi funzionali.
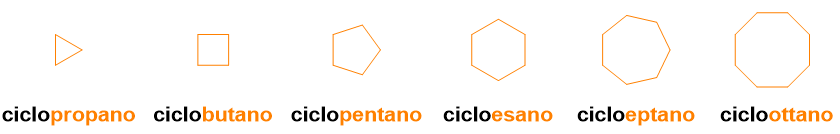
Quindi fin qui hai già imparato a dare il nome a tutti gli alcani lineari da 1 a 100. La buona notizia è che ti basterà aggiungere il prefisso ciclo- per dare il nome anche ai corrispondenti cicloalcani (vedi la Figura 3, sottostante, per un esempio).
Cosa succede alla nomenclatura se sulla struttura principale c’è un doppio legame? Dovrai semplicemente usare la desinenza –ene, anziché –ano, come visto in Tabella 2.
Nella figura in basso (Figura 4) puoi vedere i primi due esempi di molecole con doppi legami, noti come alcheni: l’etene con due atomi di carbonio e il propene con tre atomi di carbonio. Tuttavia, entrambi hanno anche nomi comuni, ancora oggi molto usati: etilene e propilene.

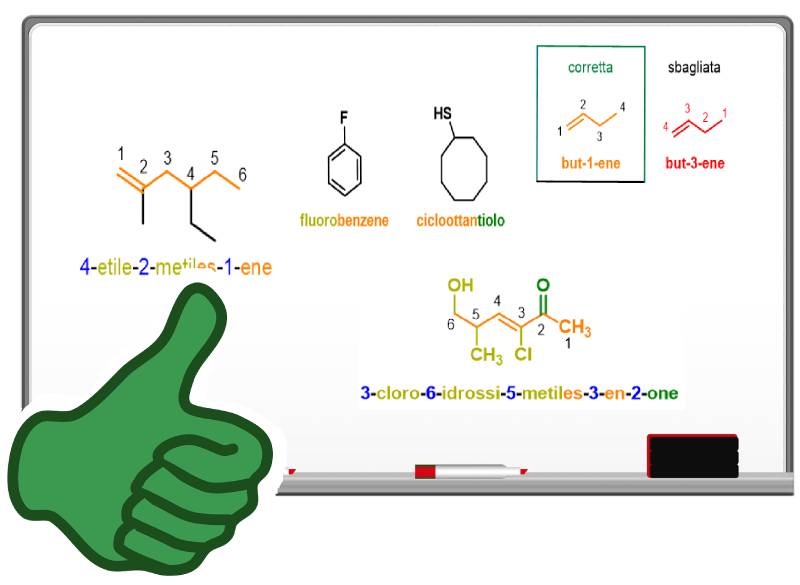
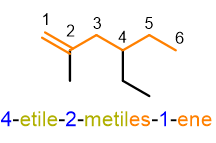
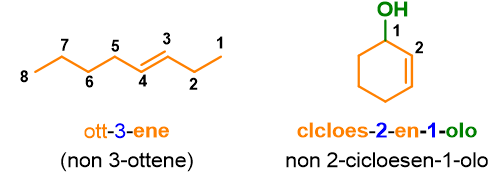
Ma cosa succede per gli alcheni con un numero di atomi di carbonio superiore a 3? In questo caso dovrai aggiungere un numero arabo vicino alla desinenza -ene per indicare la posizione del doppio legame sulla catena. Per fare ciò dovrai assegnare dei numeri ad ogni atomo di carbonio presente sulla catena principale in modo da dare il numero più basso ai carboni con il doppio legame.
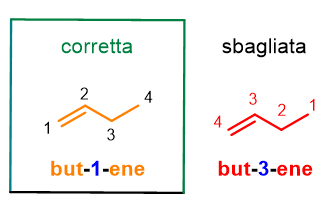
Come puoi vedere dalla Figura 5, but-1-ene è la nomenclatura corretta rispetto a but-3-ene, perché la catena è numerata in modo da dare al doppio legame il numero più basso. Valuta, inoltre, che la dicitura 1-butene non è più accettata dalla IUPAC, perché le nuove disposizioni impongono di mettere il numero arabo direttamente vicino alla parola a cui si riferisce. Seguono altri esempi che potrai usare per esercitarti.
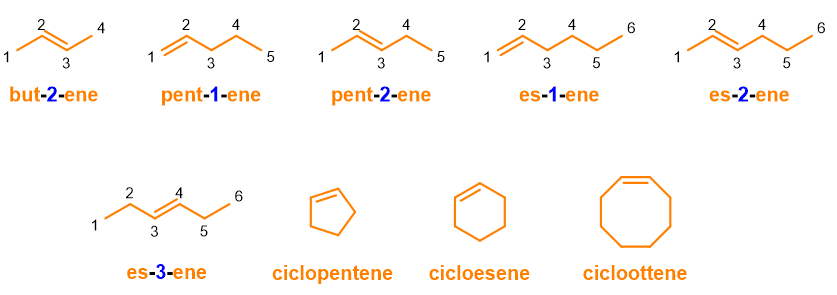
In Figura 6 puoi notare come i cicloalcheni, con un solo doppio legame, non abbiano bisogno di numerazione; in questo caso sarebbe, infatti, superfluo numerare la catena. Tuttavia la IUPAC scoraggia di omettere i numeri di posizione tutte le volte che la numerazione è superflua per logica, ma nel caso dei cicloalcheni l’omissione è accettata.
Sappi che ora hai raggiunto un’altra tappa: sai dare il nome anche agli alcheni!
Non ci resta che aggiungere gli alchini, ossia i composti con triplo legame. La costruzione del loro nome è identica a quella degli alcheni, solo che bisognerà sostituire la desinenza –ene con –ino (Tabella 2): radice + numero + ino. Seguono alcuni esempi in Figura 7.
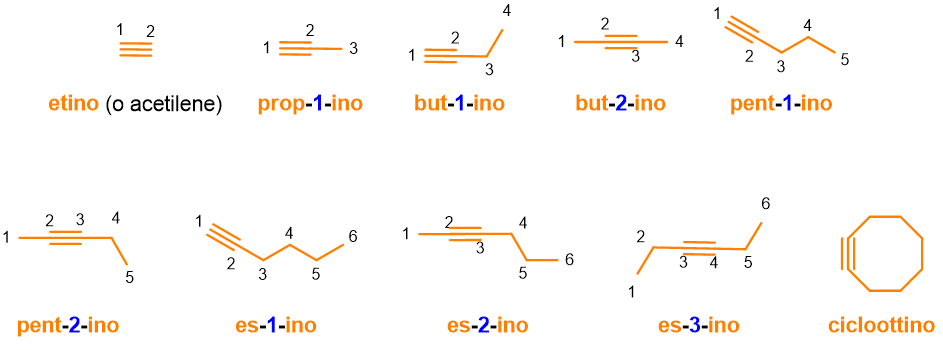
Nomi delle radici dei composti aromatici
Le radici non sono solo i numeri di atomi di carbonio della catena alchilica più lunga, come visto in Tabella 1, perché non sempre la struttura principale è una catena alchilica. Dunque, le tabelle sottostanti raccolgono i nomi di vari composti che possono fungere da radici.
Iniziamo elencando i nomi legati alla molecola del benzene (Tabella 3). La Tabella 3 riporta in alcuni casi una doppia nomenclatura, quella comune e quella IUPAC, come nel caso del toluene che in realtà dovrebbe essere chiamato metilbenzene secondo la IUPAC. Nel caso dello xilene, la IUPAC raccomanda di usare i numeri arabi per indicare la posizione dei metili, dato che la nomenclatura orto (o-), meta (m-), para (p-) è ormai considerata obsoleta. Lo xilene potrebbe anche essere chiamato dimetilbenzene, tuttavia il termine comune xilene è stato mantenuto per tradizione.

Nella Tabella 4 sono, invece, illustrati i nomi tipici di alcuni composti policiclici aromatici e parzialmente aromatici.
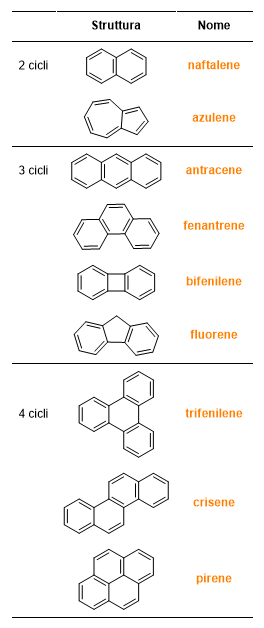
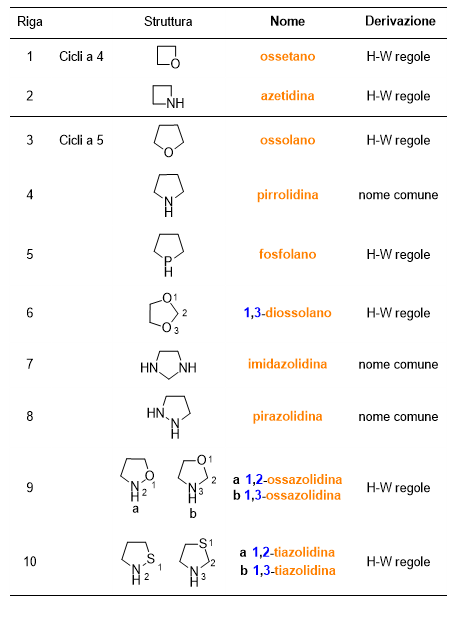
Nomi delle radici dei composti eterociclici
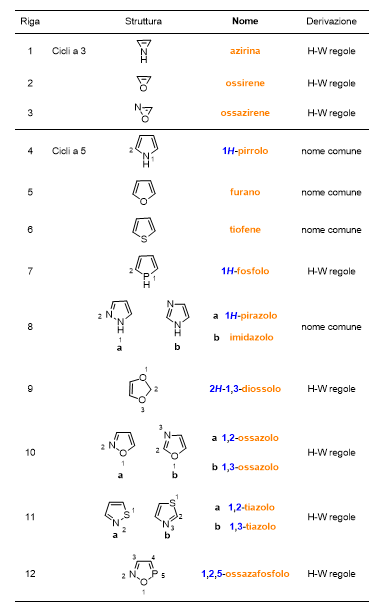
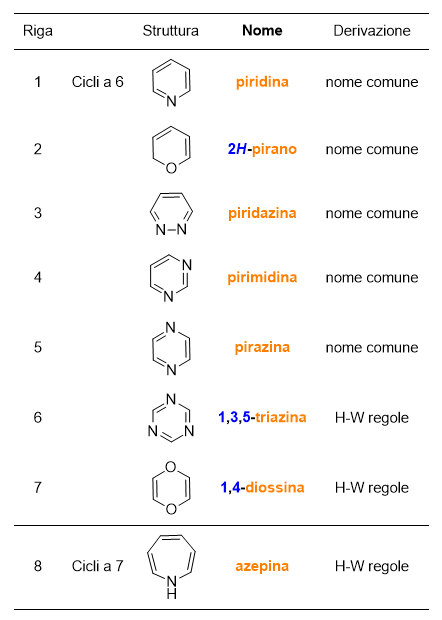
Continuiamo con i composti eteromonociclici insaturi, che puoi trovare in Tabella 5 e 6 (Scorri per vedere entrambe le tabelle).
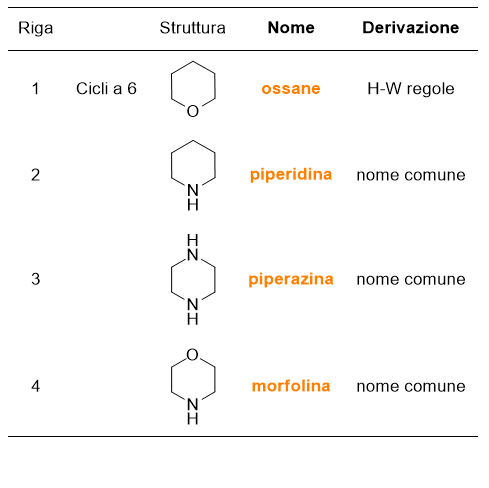
Poi i composti eteromonociclici saturi, che trovi in Tabella 7 e 8.
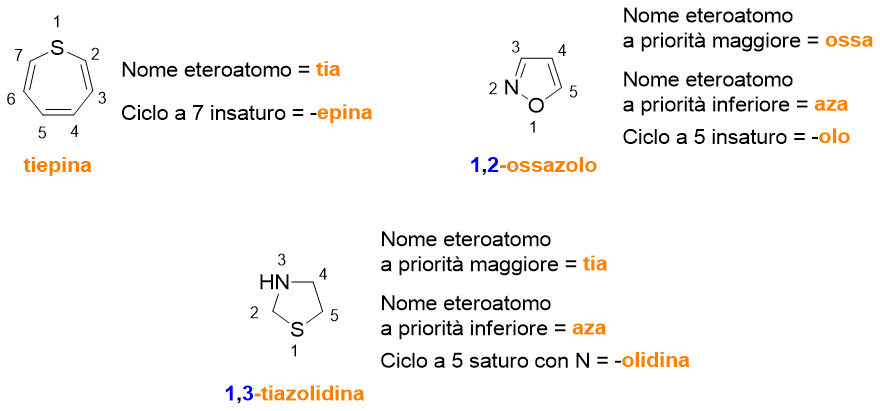
Per quanto riguarda i composti eterociclici (Tabelle 5-8), ci sono da fare delle importanti considerazioni. Non tutti i nomi di questi composti sono di derivazione comune, ma la maggior parte deriva da regole precise adottate dalla IUPAC, lì dove il nome comune del composto non fosse troppo diffuso. Puoi vedere nell’ultima colonna delle tabelle in questione se il nome del composto deriva da nomi comuni o dalle regole di Hantzsch-Widman (H-W). Ma cosa sono queste regole?
Sono le regole per dare il nome a monocicli contenenti eteroatomi. Questo sistema di regole si basa sull’assegnare dei nomi, che finiscono con la lettera ‘a’, agli eteroatomi e di dare delle priorità agli stessi.
La tabella che segue (Tabella 9) elenca solo alcuni dei nomi degli eteroatomi, iniziando da quello a priorità maggiore fino a quello a priorità inferiore. In realtà non è difficile ricordare la priorità degli eteroatomi secondo le regole di H-W, perché la priorità maggiore è data agli elementi del gruppo 17 della tavola periodica (es. F detto fluora) seguiti da quelli del gruppo 16 (es. O detto ossa), poi 15 (es. N detto aza), poi 14 e infine 13.

Dopo aver dato il nome all’eteroatomo, le regole di H-W prevedono di aggiungere al nome dell’eteroatomo un suffisso che indichi la grandezza del ciclo e la saturazione del medesimo. Tali nomi sono elencati in Tabella 10. Alcuni di questi nomi fanno riferimento a un particolare eteroatomo, in tal caso trovi tra parentesi l’atomo a cui il suffisso si riferisce.

Nel mettere insieme il nome dell’eteroatomo (Tabella 9) e quello del ciclo (Tabella 10), la lettera ‘a’ finale nel nome dell’eteroatomo viene persa.
Seguono tre esempi (Figura 8). Come puoi vedere occorre indicare la posizione degli eteroatomi mediante il solito numero arabo per la posizione. Il numero più basso è dato all’eteroatomo con priorità maggiore, che verrà anche citato per primo.
Suffissi e prefissi
Abbiamo finora visto quali possono essere le radici e le desinenze, che sono la base del nome in chimica organica. Tuttavia la vera caratteristica al nome viene data dal suffisso, il suffisso dà la direzione al nostro treno. Se, infatti, la radice era la locomotiva del nostro treno immaginario, il suffisso è il vagone del pilota del treno. Darà la direzione all’intera macchina.
Dunque siamo nel cuore del nostro problema e la domanda che ci si pone davanti è: “Come trovare il suffisso?”. Prima di trovarlo, però, capiamo cos’è:
- Il suffisso è la parte del nome da inserire direttamente dopo radice e desinenza; esso si riferisce al gruppo principale caratteristico di quella molecola. Il gruppo principale è quello a priorità maggiore nella molecola.
Quindi per trovare il gruppo principale all’interno della nostra struttura basterà consultare le tabelle sulla priorità dei gruppi e vedere il nome del suffisso per tale gruppo.
Nella tabella (Tabella 11), che segue, potrai facilmente trovare il suffisso da usare. Nella tabella, infatti, i vari gruppi funzionali sono ordinati dal gruppo a maggiore priorità fino a quello a minore priorità. La stessa tabella inoltre elenca anche i prefissi. Come mai? La risposta è semplice: tutti quei gruppi all’interno della molecola che non hanno la priorità più alta verranno nominati come prefissi da mettere prima della radice.

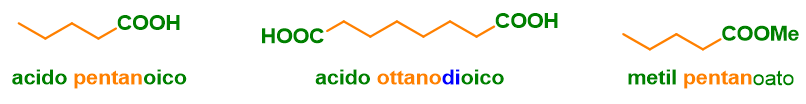
Puoi notare dalla tabella di sopra che nei casi in cui il gruppo funzionale abbia un atomo di carbonio (ad esempio nel caso degli acidi carbossilici e suoi derivati) tale atomo di carbonio può essere considerato “estraneo” rispetto alla catena principale e, in tal caso, il suffisso avrà in sé il termine carb– a indicare un atomo di carbonio. Ad esempio per l’acido carbossilico tale suffisso è –carbossilico, per l’estere è carbossilato, per il nitrile è –carbonitrile e così via. Nel caso opposto invece, ossia quando l’atomo di carbonio del gruppo funzionale caratteristico è considerato parte integrante della catena principale, allora dovrai usare la dicitura senza il termine carbo, indicata in tabella. Ad esempio per l’acido carbossilico, il suffisso diventa –oico preceduto dalla parola acido.
Facciamo degli esempi per capire questo punto e come muovere i primi passi con la Tabella 11, in generale.
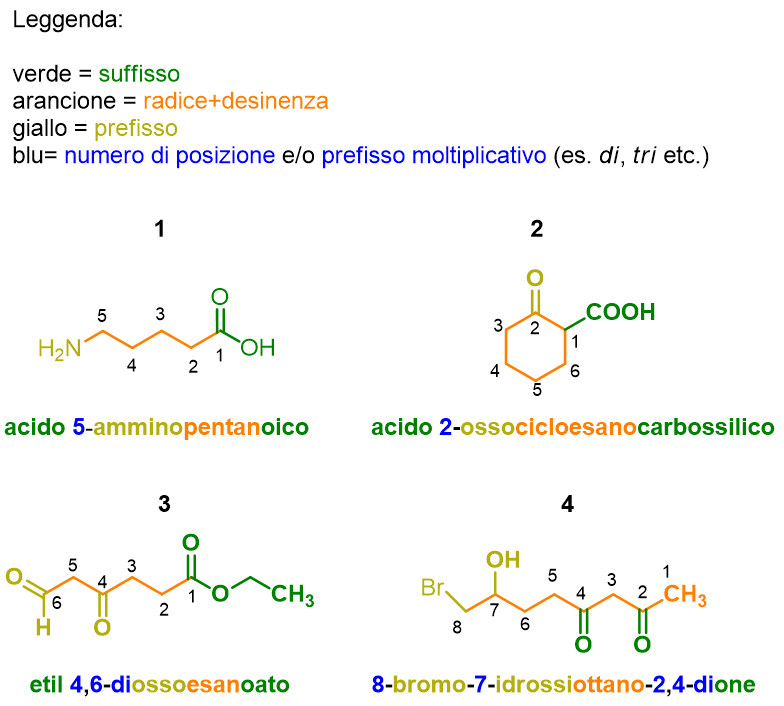
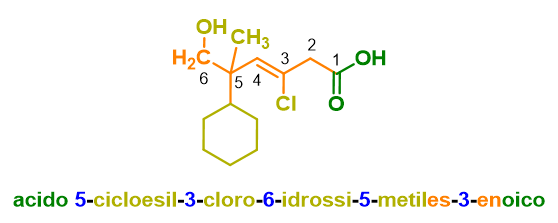
La molecola 1 in Figura 9, ha come gruppo a priorità maggiore l’acido carbossilico, che quindi sarà il suffisso; il gruppo amminico, invece, avendo priorità più bassa fungerà da sostituente (ammino-). La radice è la catena alchilica a 5 atomi di carbonio (pentano), la lunghezza include anche l’atomo di carbonio dell’acido carbossilico, perciò il suffisso verrà indicato come (acido… –oico). La numerazione della catena è fatta, inoltre, partendo dal gruppo a priorità maggiore, quindi l’acido carbossilico a cui viene assegnato il numero 1. Dalla numerazione si capisce anche il numero di posizione da assegnare all’ammina (5). Mettendo insieme i pezzi si ottiene: acido 5–amminopentanoico.
La molecola 2 in Figura 9 è un esempio di gruppo caratteristico non incluso nella catena principale. Infatti la catena principale in questo caso è il ciclo a 6 (cicloesano), che sarà quindi la radice del nome. Tuttavia l’atomo di carbonio del gruppo a priorità maggiore (l’acido carbossilico) non è incluso nella catena principale, quindi il suffisso questa volta sarà acido…carbossilico (non acido…-oico). La molecola presenta anche un gruppo carbonilico, che però avendo priorità inferiore rispetto all’acido carbossilico sarà trattato da sostituente (osso). La numerazione è fatta partendo dall’acido carbossilico e poi passando per il chetone in modo da dare ai gruppi funzionali il numero più basso possibile. Mettendo insieme i pezzi si ottiene: acido 2–ossocicloesanocarbossilico.
Nell’esempio 3 in Figura 9, il ragionamento è lo stesso, solo che essendo il gruppo a priorità maggiore un estere, occorre indicare come primo elemento il sostituente legato al gruppo OR dell’estere, che in questo caso è l’etile (il perché viene chiamato etile e non etano, lo vedremo tra pochissimo).
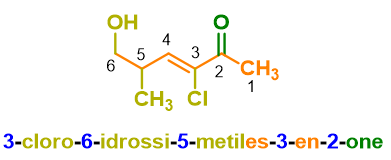
Nell’esempio 4, infine, i gruppi a priorità maggiore sono due chetoni che verranno quindi indicati con il suffisso –one ma preceduto dal prefisso moltiplicativo di-, a indicare la presenza di due gruppi uguali. I sostituenti sulla catena principale (ottano) sono un gruppo ossidrilico e un alogeno, i due sostituenti vengono nominati in ordine alfabetico, quindi prima bromo– e poi idrossi-.
Come abbiamo già accennato i prefissi che indicano i sostituenti non sono solo quelli elencati nella Tabella 11, perché altri sostituenti sono possibili in chimica organica, come i sostituenti alchilici e alogeni.
Tali sostituenti sono elencati in Tabella 12 e sono quei sostituenti che sono sempre a priorità più bassa e che quindi verranno sempre e solo identificati come prefissi.
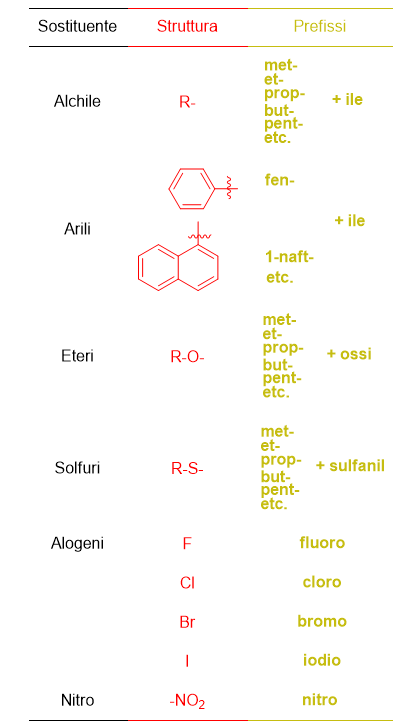
Tra questi sostituenti ci sono i sostituenti alchilici, i quali vengono nominati con le stesse radici usate per gli alcani (met- et- prop- etc) ma con la desinenza –ile, a indicare che si tratta di un sostituente. Similmente, i sostituenti arilici hanno il nome del composto di partenza, ma seguito dalla desinenza –ile, es. naft+alene diventa naft+ile. Il benzene in questo caso ha un nome particolare da sostituente ed è fenile, questo è da ricordare a memoria. Gli eteri sono nominati con la solita radice a indicare il numero di atomi di carbonio (met-, et-, prop-, etc) seguiti dal termine –ossi.
Atri sostituenti sono i solfuri che si nominano come gli eteri, ma facendoli seguire dal termine –sulfanil, gli alogeni, denominati come gli elementi a cui si riferiscono, e il gruppo nitro, detto appunto nitro.
Numeri di posizione e prefissi moltiplicativi
Non ci resta che vedere gli ultimi due termini usati nella nomenclatura organica: i numeri di posizione e i prefissi moltiplicativi.
I primi li abbiamo già in parte visti, sono i numeri arabi che indicano la posizione dei sostituenti e delle insaturazioni. Essi vengono assegnati dando il numero più basso al gruppo a priorità maggiore e successivamente dando il numero più basso ai sostituenti presenti. Tali numeri sono separati tra loro usando le virgole (es. 1,2) e separati dal nome usando trattini (es. 2,3-dimetilottano) e vengono posizionati direttamente vicino alla parola a cui si riferiscono (vedi esempi sotto). Un apostrofo è aggiunto quando uno stesso numero viene ripetuto (es. 2,2’-dimetilesano).
La IUPAC raccomanda di scrivere i numeri di posizione anche in casi in cui sarebbe superfluo e ne permette l’omissione solo in un ridotto numero di casi:
- Acidi carbossili e dicarbossilici aciclici e tutti i loro derivati (es. ammidi, esteri etc.), Figura 11;
- Catene alchiliche con un solo atomo di carbonio (es. CH3Cl clorometano, CH2Cl2 diclorometano);
- Catene alchiliche a due atomi di carbonio monosostituite (es. CH3CH2OH etanolo);
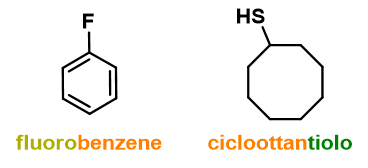
- Cicli monosostituiti (vedi Figura 12);
- Alcheni e alchini non sostituiti a 2 e 3 atomi di carbonio e cicloalcheni e cicloalchini non sostituiti.

Riguardo all’uso dei numeri di posizione, c’è da dire un’ultima cosa: fanno eccezione all’uso dei numeri di posizione le ammine e le ammidi; qui, infatti, i sostituenti sull’azoto vengono indicati con tante lettere N corsive quanti i sostituenti presenti sull’azoto.

Restano ora da chiarire i prefissi moltiplicativi. Questi sono prefissi da usare nel caso di frammenti che si ripetono all’interno della molecola. Il tipo di prefisso moltiplicativo da usare dipende dalla complessità del frammento. Per sostituenti semplici si usano i termini di-, tri, tetra- etc., mentre per frammenti più complessi si usano i corrispondenti bis-, tris-, tetrachis, etc. La tabella che segue elenca alcuni di questi prefissi.
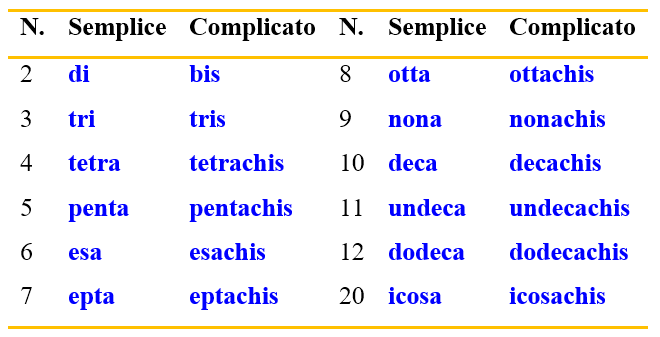
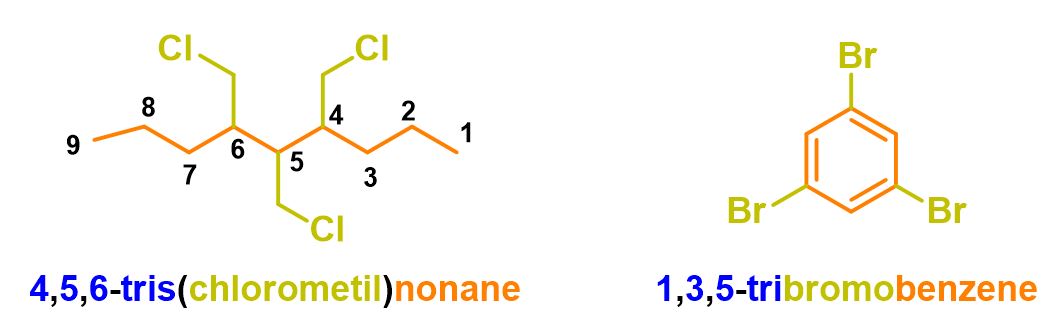
Per capire meglio come usare tali prefissi, puoi vedere gli esempi in Figura 15.
Le regole per scrivere un nome in chimica organica
Riassunto e regole
Dunque, abbiamo finora visto tutti i pezzi che compongono un nome in chimica organica. Per ricapitolare possiamo riprendere la similitudine del treno; come il treno è fatto da vari vagoni, così un nome in chimica organica è fatto da vari blocchi:
- La radice + desinenza che individua la catena principale e il grado di insaturazione (desinenza). È questo il vagone locomotiva, perché come senza di esso il treno non potrebbe muoversi, così senza di esso il nostro nome non esisterebbe affatto.
- Il suffisso, il vagone di comando, quello dove il pilota dà la direzione e velocità al treno. Il suffisso, infatti, dà la direzione al nostro nome, perché ci dice quale gruppo più importante in priorità è sulla nostra molecola. Nella Tabella 11 abbiamo elencato questi gruppi in ordine crescente di priorità e ne abbiamo dato i nomi dei suffissi.
- I prefissi, che vanno a dare il nome ai sostituenti, ossia a tutti quei gruppi che dopo il gruppo funzionale caratteristico hanno priorità inferiore. Ci sono due tipi di prefissi: a) i prefissi appartenenti ai gruppi di Tabella 11 a priorità più alta (il vagone dei passeggeri di prima classe); b) i prefissi appartenenti ai gruppi funzionali che si comportano sempre e solo da sostituenti, elencati in Tabella 12, (il vagone per i passeggeri della classe economica).
- Numeri di posizione e prefissi moltiplicativi per indicare la posizione e il numero dei sostituenti rispettivamente.
Dunque, data la composizione di un nome in chimica organica, è lecito chiedersi a questo punto: “Ci sono delle regole per mettere insieme i vari pezzi con un certo criterio?”
Certo che sì! e tali regole sono elencate di seguito. Data la molecola da nominare:
- Determina subito qual è il gruppo funzionale caratteristico, vedendo la Tabella 11. Il gruppo a priorità più alta è quello caratteristico, perciò segnati a parte il suo nome come suffisso. Se la molecola non ha un gruppo funzionale caratteristico, come nel caso degli alcani, alcheni etc., il nome non conterrà alcun suffisso e puoi andare direttamente al punto 2.
- Determina la catena principale che è attaccata al gruppo funzionale caratteristico, danne il nome (radice) e specifica il grado di insaturazione aggiungendo la desinenza –ano, -ene o –ino alla radice.
- Combina il nome della radice + desinenza con quello del suffisso.
- Identifica i sostituenti (Tabella 11 e Tabella 12) e metti i loro prefissi in ordine alfabetico.
- Inserisci i prefissi moltiplicativi, se necessari, senza cambiare l’ordine alfabetico che hai già dato ai prefissi.
- Numera la catena principale in modo da dare il numero più basso al gruppo a priorità maggiore e poi più basso per i sostituenti restanti. Inserisci, quindi, nel nome, i numeri di posizione per sostituenti, insaturazioni e gruppo caratteristico principale ove necessario.
Esercizi svolti
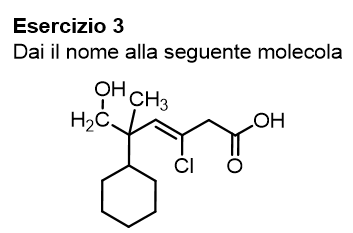
Concludiamo questa parte dell’articolo relativa ai nomi sostitutivi, eseguendo degli esercizi insieme.
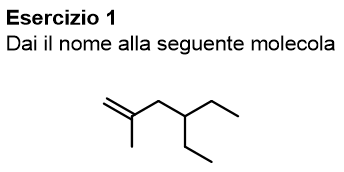
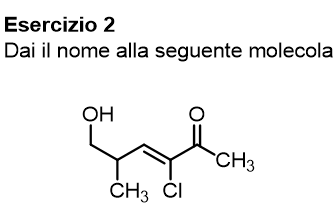
Iniziamo da questa prima molecola, prova a dare il nome da solo e poi scopri la nostra spiegazione cliccando su ‘vedi soluzione’.
Nomenclatura dei gruppi funzionali
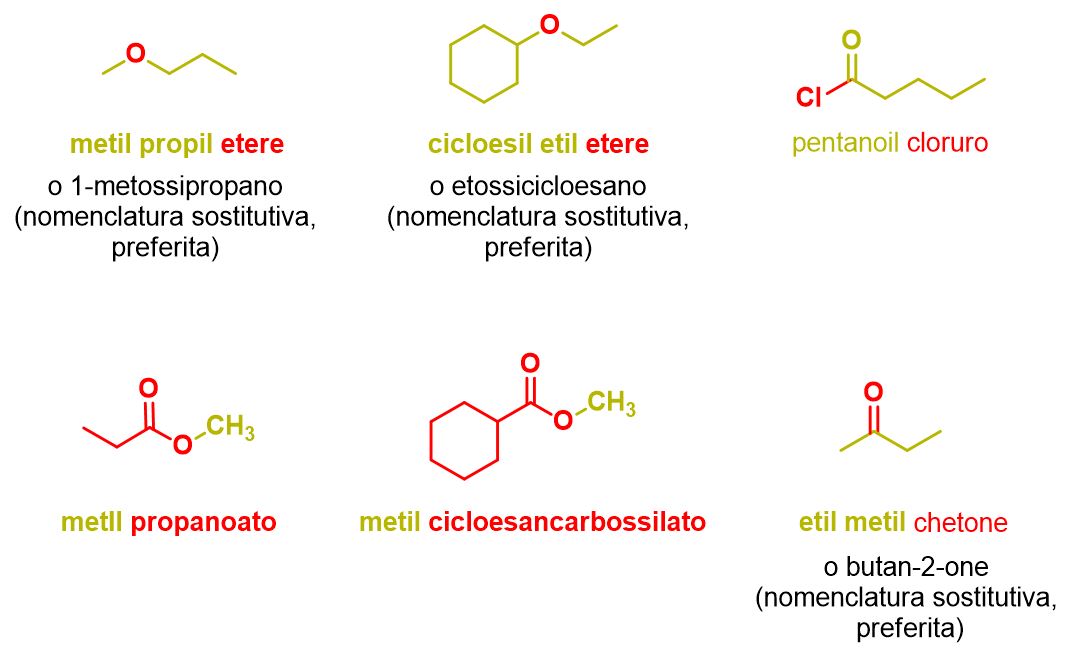
Abbiamo finora visto la nomenclatura sostitutiva che è quella più applicata; infatti con tale nomenclatura puoi dare il nome a quasi tutti i composti organici. Tuttavia la nomenclatura dei gruppi funzionali è preferita solo nel caso di esteri e alogenuri acidi. La IUPAC, infatti, incoraggia ad usare la nomenclatura sostitutiva anche per tutti quegli altri composti per i quali la nomenclatura dei gruppi funzionali è ancora diffusa, ossia eteri, chetoni, solfossidi, solfuri etc. Tale nomenclatura consiste nell’elencare i nomi dei sostituenti in ordine alfabetico, seguiti dal nome (separato da spazio) della classe a cui appartiene quel composto. Ad esempio, (CH3CH2)2O è detto dietil etere, etere è il nome della classe, mentre etil si riferisce ai due gruppi etilici attaccati all’ossigeno, che vengono trattati entrambi come sostituenti, quindi con gli stessi nomi (prefissi) visti per la nomenclatura sostitutiva.
Il nome degli alogenuri acidi e degli esteri è quello che abbiamo, in realtà, già visto in Tabella 11, solo che in questo caso parliamo di nomenclatura dei gruppi funzionali. Quindi gli alogenuri acidi (RC(=O)-X) si denominano usando il nome dell’alogenuro (X) (cloruro, bromuro etc.) preceduto dal nome del gruppo acile, che è il nome del gruppo R + –oil o R + carbonil (se il C=O non è parte della catena R). Analogamente gli esteri R’C(=O)OR vengono denominati indicando prima il nome del sostituente R, sulla parte alcolica dell’estere, e poi usando il nome del gruppo R’ + -oato o R’ + carbossilato (se il C=O non è parte della catena R’).
Gli esempi che seguono chiariranno tale nomenclatura.
Questa lezione

NOMENCLATURA
€
6.50
Trovi tutte le tabelle e figure + riassunto
Scarica pdf (non modificabile)

NOMENCLATURA
€
8.50
Trovi tutte le tabelle e figure + riassunto
Scarica docx (modificabile)
References
1) Favre, H., Powell, W. H., & Representation, S. (2014). Nomenclature of organic chemistry : IUPAC recommendations and preferred names 2013. In Royal Society of Chemistry eBooks. https://doi.org/10.1039/9781849733069.
2) Hellwich, K., Hartshorn, R. M., Yerin, A., Damhus, T., & Hutton, A. T. (2021). Brief Guide to the Nomenclature of Organic Chemistry (IUPAC Technical Report) [Dataset]. In IUPAC Standards Online. https://doi.org/10.1515/iupac.92.0027