Introduzione
Come posso far reagire un reagente in acqua con un reagente in un solvente organico non miscibile con acqua? A prima vista la reazione sarebbe impossibile dato che i reagenti, trovandosi in fasi diverse, non potrebbero venire in contatto tra loro e quindi reagire.
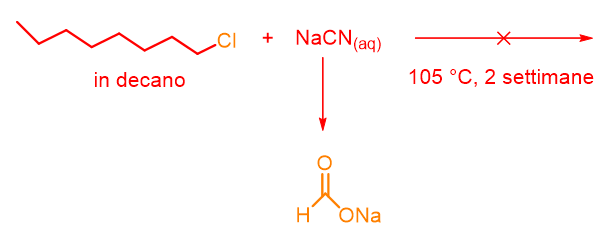
Molto studiata a tal proposito fu la reazione tra 1-cloroottano (in decano) e cianuro di sodio in acqua (Schema 1). La reazione, condotta a 105 °C, dopo due settimane produceva solo l’idrolisi del cianuro a formiato di sodio (HCOONa).
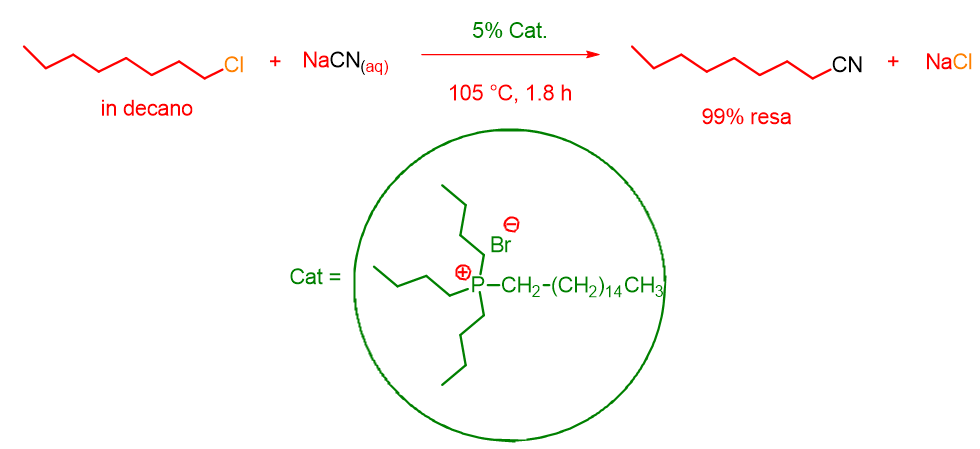
Nel 1971 il chimico Charles M. Starks[1] dimostrò come tale reazione poteva essere condotta in fase eterogenea a patto però di aggiungere un sale di ammonio o di fosfonio quaternario solubile in fase organica. Infatti, conducendo la reazione con 5% di esadeciltributilfosfonio bromuro si ottenne 99% di resa in cianoottano dopo solo 1.8 ore (Schema 2).
Questo fu uno dei primi esempi di catalisi a trasferimento di fase (in inglese è phase transfer reaction, da cui l’abbreviazione PTC)

Vuoi stampare questo articolo o salvarlo sul tuo computer e leggerlo offline? Puoi fare il downoald del file pdf qui. In alternativa trovi anche il file docx se ti serve apportare modifiche al documento.
Definizione
La catalisi a trasferimento di fase è una tecnica per condurre reazioni tra due o più reagenti, che si trovano in due o più fasi diverse, grazie all’uso di un agente a trasferimento di fase. Tale agente si occupa di trasferire una specie chimica nella fase in cui è presente l’altra specie chimica con cui deve reagire. È necessario, però, che la specie trasferita venga anche attivata verso la reazione affinché si possano usare solo quantità catalitiche dell’agente a trasferimento di fase.
Quindi la catalisi a trasferimento di fase funziona tramite una duplice azione: trasferimento di un reagente e sua attivazione.
La maggior parte delle reazioni a trasferimento di fase coinvolgono il trasferimento di un anione perché le stesse reazioni organiche in prevalenza avvengono tramite anioni; in tal caso il trasferimento è eseguito principalmente da sali quaternari. Tuttavia i catalizzatori neutri come eteri corona, criptandi e polietilenglicole (PEG) trasferiscono in fase organica sia l’anione sia il catione. Infine recentemente sono comparsi i primi esempi di PTC anche per trasferire cationi tramite catalizzatori anionici.[2]
In questo breve articolo ci riferiremo soprattutto al trasferimento di anioni tramite sali di ammonio e fosfonio quaternari; tuttavia non mancheranno riferimenti, dove opportuno, al trasferimento da parte dei catalizzatori neutri.
Attivazione dell’anione
Come accennato poco sopra, il catalizzatore a trasferimento di fase oltre a trasferire l’anione lo attiva anche. L’attivazione avviene perché il legame tra il catalizzatore e l’anione ha una distanza maggiore rispetto a quella dell’anione e del suo controione. Per esempio si confrontino le distanze anione-catione in NaBr e nel tetrabutilammonio bromuro (Figura 1).
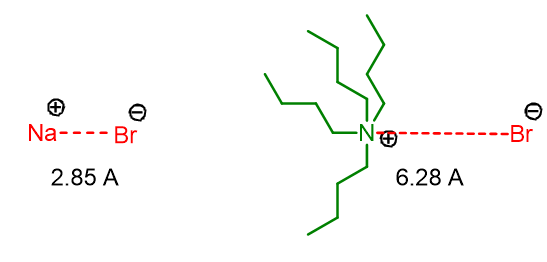
L’incrementata distanza in Q+Br– rende l’anione Br– più nudo e quindi più reattivo verso l’elettrofilo in fase organica.
Un altro meccanismo di attivazione è dovuto al fatto che il trasferimento dell’anione in fase organica tramite il catalizzatore comporta minore presenza di acqua di idratazione intorno all’anione, rendendo quest’ultimo più nudo e quindi più reattivo.
Meccanismi del trasferimento di fase
A seconda del tipo di catalizzatore e di reagenti usati sono possibili vari meccanismi che elenchiamo qui sotto.
Trasferimento semplice
Usiamo la reazione del cianuro con 1-cloroottano, vista precedentemente, come esempio di trasferimento semplice. Tale meccanismo avviene secondo lo schema seguente:
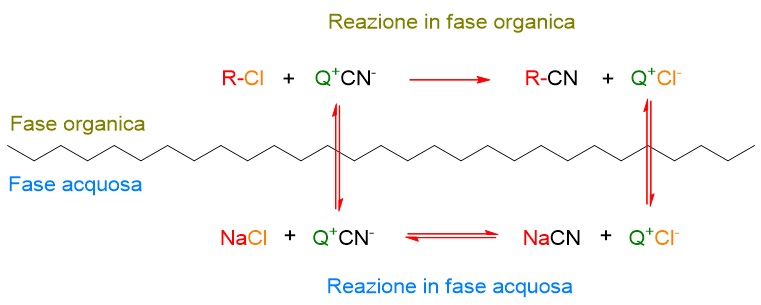
Come si vede lo ione CN– viene trasferito dalla soluzione acquosa alla soluzione organica dal sale di ammonio o fosfonio quaternario (Q+). In soluzione organica, lo ione CN–, che ora è anche più reattivo, reagisce con R-Cl a dare R-CN. Nello stesso tempo il catalizzatore a trasferimento di fase (Q+) lega il controione Cl– e lo porta in fase acquosa. Il Cl– ristabilisce l’elettro-neutralità della fase acquosa, la quale, avendo perso precedentemente l’anione CN–, aveva un eccesso di cariche positive sotto forma di Na+. Si forma così NaCl in fase acquosa.
Questo meccanismo si può facilmente ricordare pensando a Q+ come a un servizio navetta che trasporta un anione dalla fase acquosa alla fase organica, lo attiva alla reazione e porta indietro in fase acquosa l’altro anione che è stato rimpiazzato.
Sali quaternari molto piccoli, come (CH3)4N+, sono solubili solo in fase acquosa e quindi non riescono a trasferire l’anione in fase organica impedendo la reazione. Invece, sali quaternari relativamente piccoli, ossia recanti catene alchiliche da 2 a 4 atomi di carbonio, sono capaci di ripartirsi tra la fase organica e quella acquosa facilmente secondo il meccanismo a trasferimento semplice. D’altro canto, i sali quaternari, con catene dai 5 a 8 atomi di carbonio, pur restando per il circa 95% in fase organica, danno le conversioni più alte del processo complessivo.
L’uso di catene alchiliche ancora più lunghe sui sali quaternari comporta una perdita di attività da parte del catalizzatore, il quale sarà solubile quasi esclusivamente in fase organica perdendo l’abilità di ripartirsi in fase acquosa e quindi di attuare il trasferimento dell’anione.
Trasferimento semplice attraverso l’interfaccia
Il secondo meccanismo prevede lo scambio anionico all’interfaccia tra le due fasi. Il sale quaternario in tal caso non va in soluzione acquosa ma si limita a effettuare il trasferimento all’interfaccia (Schema 4).
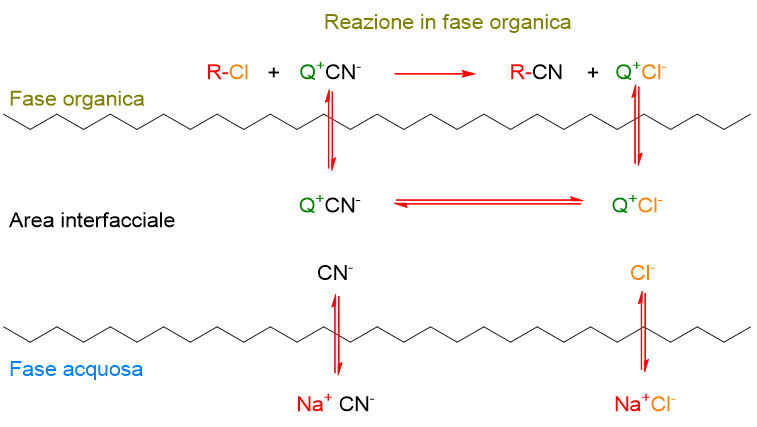
I sali quaternari con catene alchiliche lunghe tipo tetraesil e tetraoctil danno questo tipo di meccanismo, dato che sono ripartiti principalmente in fase organica (99%), ma possono interagire all’interfaccia. Sali con catene eccessivamente lunghe, completamente insolubili in acqua, tuttavia, non riescono a interagire opportunamente all’interfaccia e la reazione risulta limitata in velocità dal trasferimento di fase.
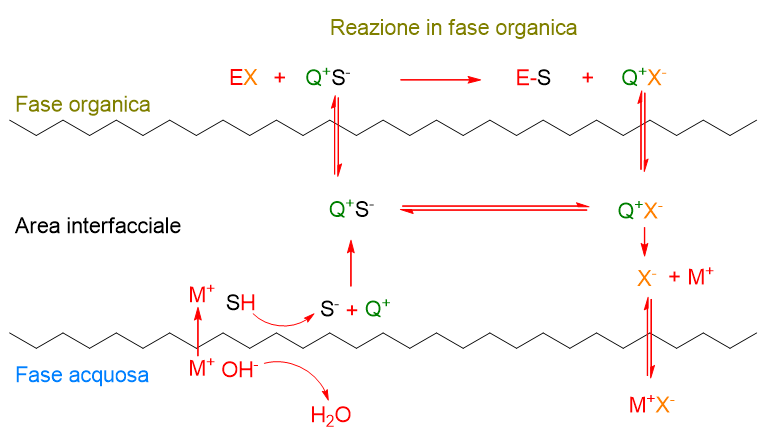
Formazione anione all’interfaccia senza catalizzatore
In alcuni casi di reazioni catalizzate da basi, il meccanismo prevede la presenza della base stessa all’interfaccia (es OH– nello Schema 5). La base deprotona una molecola organica acida (SH), trasformandola in anione (S–). Solo a questo punto interviene il catalizzatore a trasferimento di fase (Q+) che trasporta l’anione dall’interfaccia nella parte interna della fase organica, dove avviene la reazione tra l’anione e l’elettrofilo (EX). Il controione dell’elettrofilo (X–) viene portato all’interfaccia dal catalizzatore e poi va in fase acquosa insieme al catione M+ proveniente dalla base.
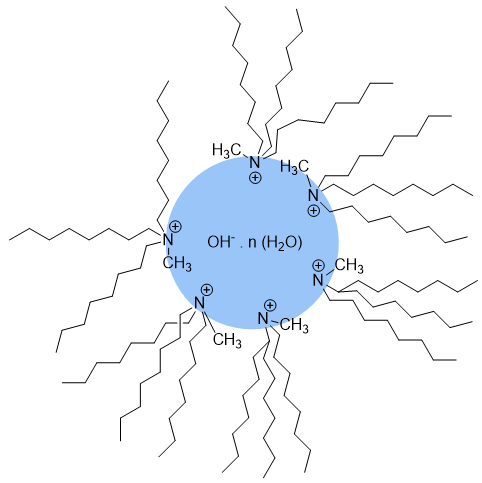
Trasferimento attraverso micelle inverse
Ioni molto idratati, come soluzioni diluite di sodio idrossido, fluoruro e solfato, rendono impossibile il consueto meccanismo a trasferimento semplice o per interfaccia e seguono un meccanismo a micelle inverse. Questo perché essendoci troppe molecole di acqua fortemente legate all’anione, l’anione non riesce a distaccarsi da esse ed è bloccato in fase acquosa. Un modo per abbassare la barriera al trasferimento è la formazione di micelle inverse (Figura 2), dove il sale quaternario forma una struttura micellare intorno all’anione idrato, posizionando le catene idrofobiche all’esterno e la parte cationica all’interno. La micella si ripartisce in fase organica, trasferendovi di fatto l’anione con le sue molecole di acqua. Di conseguenza, il reagente in fase organica può penetrare all’interno della micella attraverso la zona organofilica delle catene del sale quaternario. A questo punto la reazione può avvenire.
Formazione di una terza fase
Quando il catalizzatore non è solubile né in fase acquosa né in fase organica, esso forma una terza fase. In questo caso il meccanismo comporta il passaggio delle specie reagenti direttamente nella fase del catalizzatore dove la reazione avviene. Tale tipo di catalisi in genere è anche più veloce delle reazioni a trasferimento in due fasi. Inoltre il catalizzatore non solubile può essere rimosso con facilità alla fine della reazione e recuperato.
Trasferimento di molecole neutre
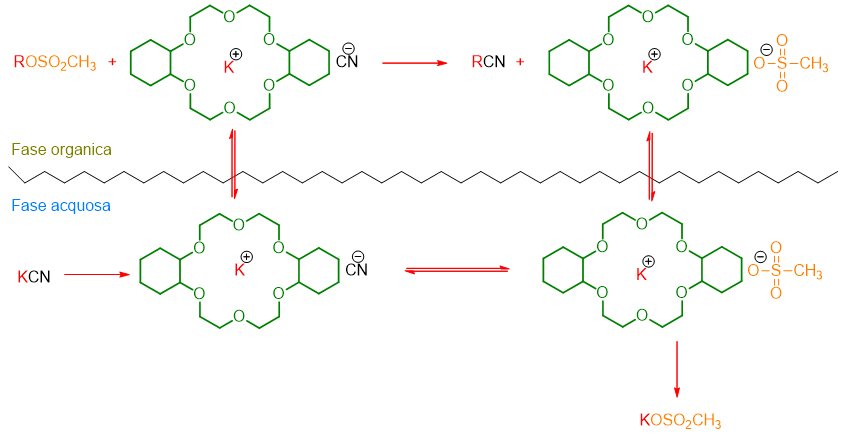
I catalizzatori a trasferimento di fase non sono solo cationici, ma possono anche essere molecole neutre come per esempio gli eteri corona, criptandi, polietilen glicole (PEG) etc. In questo caso il meccanismo è diverso da quelli visti sopra. Infatti consideriamo la seguente reazione eseguita per la prima volta da F. Molinari nel 1974:[3]
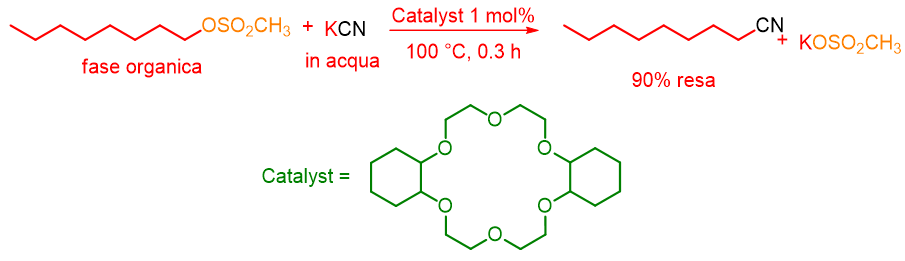
Il dicicloesil-18-corona-6 ha catalizzato la reazione di sostituzione del metansolfonato con CN– con resa del 90% in tempi brevi.
Il meccanismo della reazione avviene con l’etere corona che porta in fase organica sia il catione sia l’anione (Schema 7). In una simile situazione l’anione si trova a grande distanza dal suo controione e potrà reagire ancora più velocemente nella reazione di sostituzione, essendo uno ione nudo.
Velocità delle reazioni a trasferimento di fase
Nelle reazioni a trasferimento di fase la velocità dell’intero processo è in realtà composta da due velocità:
- La velocità della reazione in fase organica, detta velocità intrinseca;
- La velocità del trasferimento di fase.
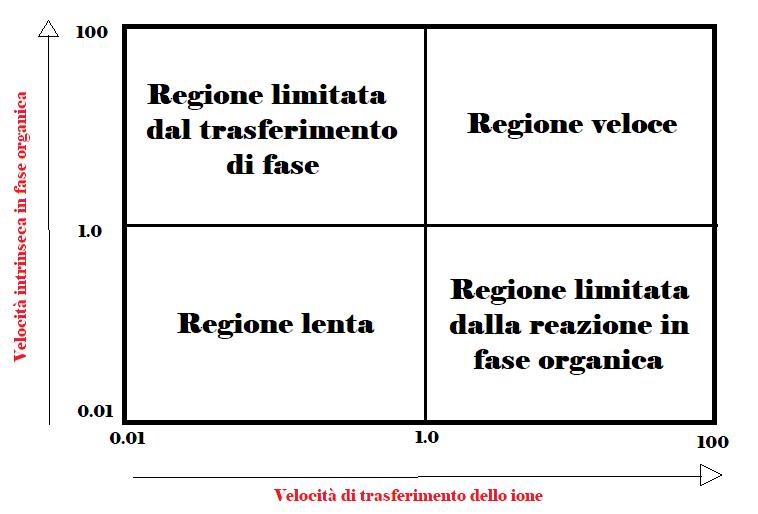
Quindi lo studio della cinetica è complicato a causa della presenza di due processi (la reazione e il trasferimento), entrambi con una propria velocità. In particolare si possono verificare quattro situazioni descritte dal grafico in Figura 3:
- La velocità della reazione intrinseca è alta, ma il trasferimento di fase è lento (quadrante in alto a sinistra). In questo caso dovremmo cercare di migliorare il trasferimento di fase;
- Il trasferimento di fase è veloce, ma la velocità intrinseca è bassa (quadrante in basso a destra). In tal caso bisogna intervenire sui parametri che influenzano la reazione in fase organica.
- Entrambe le velocità sono elevate (quadrante in alto a destra); è bene qui prestare attenzione che il processo non diventi incontrollabile.
- Entrambe le reazioni sono lente (quadrante in basso a sinistra). Questo è lo scenario peggiore perché entrambi i processi dovranno essere messi a punto.
Un esempio di reazione che avviene nella ‘’regione veloce’’ del grafico è l’ossidazione dei composti organici con permanganato.[4] Tale reazione è veloce sia perché MnO4– è uno di quegli anioni che si trasferiscono più facilmente, sia perché esso è anche molto reattivo nell’ossidazione di alcoli, alcheni, aldeidi. In aggiunta, un esempio di reazione nella ‘’regione lenta’’ è la sostituzione nucleofila effettuata con F–. Tale anione è sia difficile da trasferire in fase organica, sia è un nucleofilo debole.
Parametri che influenzano la velocità delle reazioni a trasferimento di fase
Per pianificare una reazione a trasferimento di fase è bene avere prima un’idea della velocità della reazione complessiva. A tal proposito si può pensare alla reazione come suddivisa in due step: la reazione intrinseca e il trasferimento di fase. Per capire se la reazione in fase organica sarà veloce o lenta, si può confrontare la reazione in questione con quella eseguita in fase omogenea usando i dati presenti in letteratura. Infatti è molto probabile che se una reazione in fase omogenea è lenta lo sarà anche con catalisi a trasferimento di fase.
Per quanto riguarda la velocità del trasferimento, si può avere un’idea delle prestazioni dell’anione, che intendo trasferire, consultando la letteratura sulla catalisi a trasferimento di fase che coinvolge lo stesso anione.
Infine, dopo aver studiato la letteratura, si potranno tenere in considerazione i vari parametri che possono influenzare la cinetica, tenendo presente che un singolo parametro può avere un effetto sul trasferimento di fase e un effetto opposto sulla velocità di reazione intrinseca. In tal caso è bene valutare l’influenza di ogni parametro su ciascuno dei due step.
Vediamo di seguito quali sono questi parametri e come usarli.
Struttura del catalizzatore
Il catalizzatore a trasferimento di fase può influenzare sia la velocità del trasferimento sia la velocità della reazione intrinseca e ciò dipende principalmente dalla sua struttura:
- Un sale quaternario con catene alchiliche troppo corte (es. (CH3)4N+) non potendosi bene ripartire in fase organica, limita di molto la velocità del trasferimento di fase;
- Un sale quaternario con catene abbastanza lunghe (es. sali di tetraesil- o triottil-metilammonio) può ripartirsi bene tra fase organica e fase acquosa facilitando il trasferimento di fase;
- Catalizzatori molto ingombranti (es. sali di tetraesil ammonio) vanno bene per reazioni intrinsecamente lente; infatti l’anione sarà meno legato al catalizzatore, più nudo e quindi più reattivo;
- Catalizzatori a faccia aperta (es. esadeciltrimetil ammonio), ossia molto accessibili da un lato, sono buoni per incrementare il trasferimento di fase perché aumentano l’area interfacciale di interazione con l’anione;
Se entrambe le reazioni sono lente si possono usare anche due catalizzatori, uno che incrementi il trasferimento di fase e l’altro che attivi l’anione nella reazione intrinseca.
Diversamente, se entrambe le reazioni sono veloci, quasi qualsiasi catalizzatore sarà in grado di effettuare la reazione.
Velocità di agitazione
La velocità di agitazione è molto importante nelle reazioni a trasferimento di fase perché un incremento dell’agitazione in genere comporta un aumento della velocità di trasferimento dell’anione. Questo perché l’agitazione aumenta l’area interfacciale di contatto tra la fase acquosa e quella organica, permettendo all’anione di essere trasferito.
Dunque in caso di trasferimento lento, aumentare l’agitazione della reazione può essere di aiuto; tuttavia tale strategia non avrà invece alcun effetto sulla velocità intrinseca di reazione.
Si può far uso anche di ultrasuoni come strumento di agitazione per incrementare il trasferimento dell’anione.
Tipologia e concentrazione dei sali inorganici e quantità di acqua.
Non tutti gli anioni si trasferiscono velocemente. Anioni come MnO4–, ClO4–, I– sono noti per l’alta velocità di trasferimento. Velocità intermedie risultano da ioni come Cl–, Br–, NO3–, CN–, NO2–. Mentre gli ioni più lenti a trasferire sono OH–, F–, ClO–.
In PTC l’uso di concentrazioni elevate dei sali inorganici in fase acquosa favorisce il trasferimento di fase, perché la quantità dell’ anione sarà maggiore e quindi il catalizzatore più facilmente potrà legarlo e trasferirlo. Ad esempio nel caso della reazione di sostituzione del 1-cloroottano con NaCN, alte concentrazioni di NaCN o anche l’uso come solido, favoriscono la formazione del legame Q+CN– e rendono meno competitivo in fase acquosa quello tra Q+Cl– che coinvolge il gruppo uscente.
Pertanto l’uso di concentrazioni sature dell’anione da trasferire sono consigliabili per incrementare il trasferimento di fase. Questo lo si può fare anche diminuendo la quantità di acqua presente. Talvolta poche gocce d’acqua sono sufficienti al trasferimento o addirittura basta l’acqua di idratazione del sale inorganico. Meno acqua aiuta anche ad avere meno anioni idrati, che risultano più difficili tra trasferire a causa del forte legame con le molecole di acqua.
Catalizzatori come eteri corona e PEG possono effettuare il trasferimento del composto inorganico anche a partire dal solido in assenza di acqua.
In aggiunta, il controione dell’anione da trasferire ha un ruolo importante nella solubilità dell’anione stesso. Per esempio l’uso di KCN anziché NaCN favorisce la solubilità del sale e quindi aumenta la concentrazione di ioni CN- in fase acquosa.
Temperatura
La temperatura in genere accelera le reazioni e così avviene anche in PTC, Tuttavia il catalizzatore potrebbe decomporsi a certe temperature. Per esempio i sali di ammonio quaternari sono noti per resistere fino ai 120-150°C, ma si decompongono anche a 50-70°C in soluzioni alcaline di KOH e NaOH. Gli eteri corona o i polietilenglicoli sono resistenti in condizioni basiche, ma sono sensibili a quelle acide.
L’uso del microonde in PTC ha in genere comportato un incremento della velocità del processo complessivo. La ragione di tale effetto si addebita alla capacità del microonde di interagire specialmente con l’acqua, togliendo le molecole di idratazione dall’anione, che risulta così più reattivo.
Solvente organico
A differenza di altre reazioni, la PTC offre la possibilità di non usare alcun solvente organico nel caso in cui i reagenti siano liquidi; diversamente un solvente è necessario se le sostanze organiche sono solide alla temperatura a cui si opera.
Ad ogni modo, il solvente organico ha influenza soprattutto sulla velocità intrinseca, perché se polare ma non protico può attivare l’anione verso la reazione. I solventi più usati in PTC sono diclorometano, toluene, esano, eptano. Il diclorometano è un solvente abbastanza polare da solubilizzare la maggior parte dei catalizzatori di sali quaternari e da velocizzare sia il trasferimento di fase sia la reazione intrinseca.
Si può anche scegliere un solvente in cui il catalizzatore non è solubile per favorire la formazione di una terza fase.
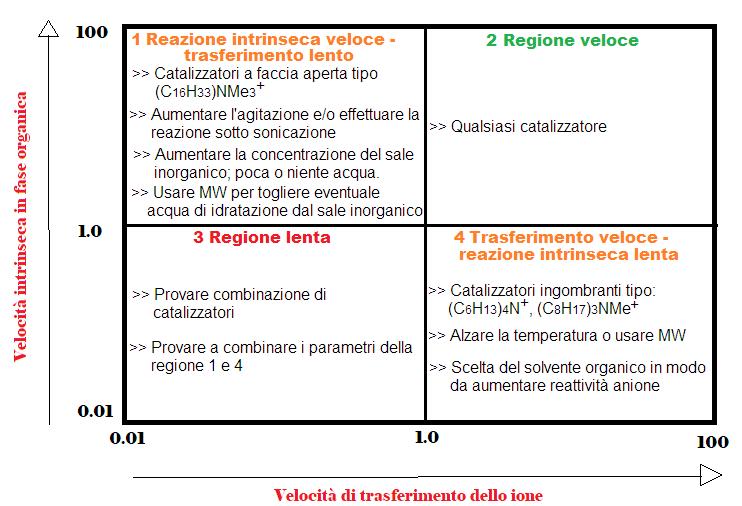
Tabella riassuntiva degli effetti della velocità in PTC
La tabella che segue riassume i parametri da cambiare per migliorare la velocità nelle reazioni PTC a seconda della situazione da cui si parte (reazione limitata dal trasferimento, reazione complessiva veloce, reazione complessiva lenta e reazione limitata dalla reazione in fase organica).
Riferimenti
1) Starks, C. M. (1971). Phase-transfer catalysis. I. Heterogeneous reactions involving anion transfer by quaternary ammonium and phosphonium salts. Journal of the American Chemical Society, 93(1), 195–199. https://doi.org/10.1021/ja00730a033;
2) Rauniyar, V., Lackner, A. D., Hamilton, G. S., & Toste, F. D. (2011). Asymmetric Electrophilic Fluorination Using an Anionic Chiral Phase-Transfer Catalyst. Science, 334(6063), 1681–1684. https://doi.org/10.1126/science.1213918;
3) Landini, D., Montanari, F., & Pirisi, F. M. (1974). Crown ethers as phase-transfer catalysts in two-phase reactions. Journal of the Chemical Society, 21, 879. https://doi.org/10.1039/c39740000879;
4) Lee, D. G. (1982). Phase Transfer Assisted Permanganate Oxidations. In Organic chemistry (pp. 147–206). Elsevier BV. https://doi.org/10.1016/b978-0-12-697253-5.50007-9;
5) Starks, C. M., Liotta, C. L., & Halpern, M. E. (1994). Phase-Transfer Catalysis: Fundamentals, Applications, and Industrial Perspectives. http://ci.nii.ac.jp/ncid/BA23074393
Questo articolo

PTC
€
2.00
Scarica pdf (non modificabile)

PTC
€
4.00
Scarica docx (modificabile)

