Introduzione
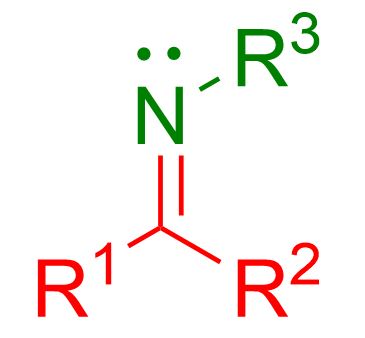
In questo articolo vediamo la reazione per formare le immine. Se non ti ricordi cos’è un immina, puoi vederne la struttura nella figura in basso.
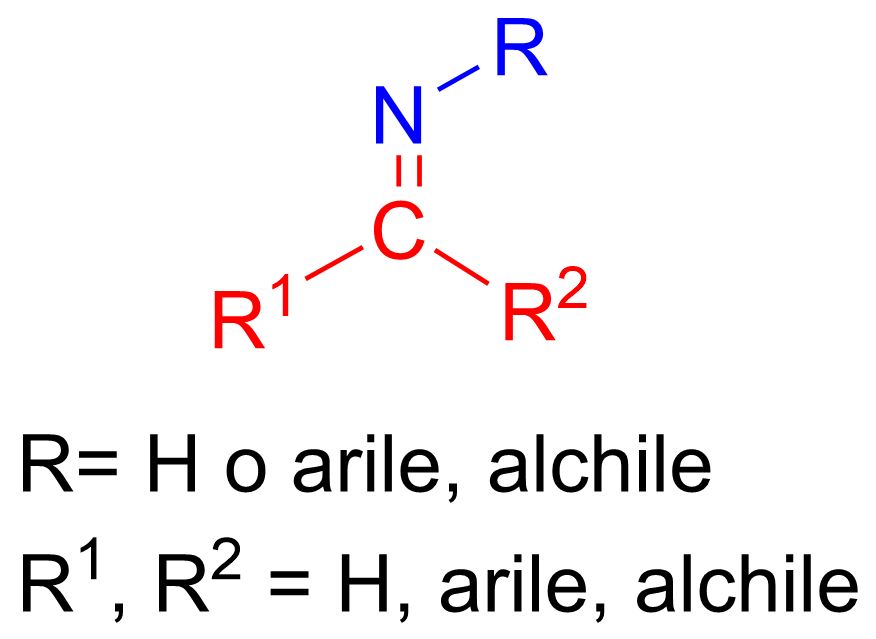
Come si vede dalla figura un’immina è caratterizzata da un doppio legame tra il carbonio e l’azoto, C=NH, o, nella maggior parte dei casi, C=NR , dove R può essere qualsiasi gruppo alchilico o aromatico.
Materiali di partenza
Per imparare come si formano le immine una volta per tutte, può essere utile capire da cosa derivano. E questo può essere fatto semplicemente guardando la loro struttura.
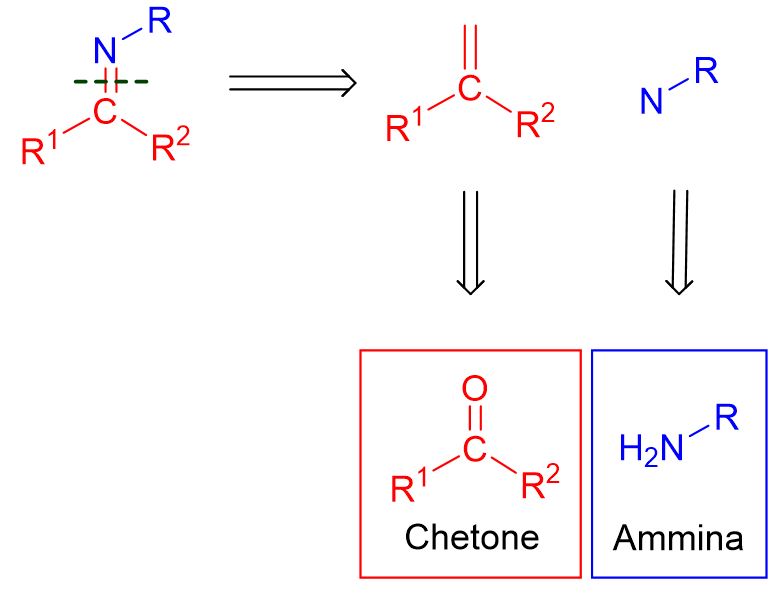
Abbiamo detto che le immine sono caratterizzate da un doppio legame tra C e N, C=N. Se noi rompiamo tale legame otteniamo i pezzi da cui l’immina è formata (vedi figura in basso). Il primo pezzo, in rosso, è un carbonio con un doppio legame. Ora la possibilità più semplice è che tale carbonio si leghi a un ossigeno. In questo modo abbiamo ricostruito la prima classe di composti necessaria per formare un immina, ossia le aldeidi e i chetoni. La seconda classe la possiamo derivare dal pezzo in blu (immagine in basso). Tale pezzo è un N-R e, se completiamo la valenza dell’azoto con dei semplici idrogeni, otteniamo un’ammina primaria.
Dunque per formare un’immina, occorono come materiali di partenza un’aldeide o un chetone e un’ammina PRIMARIA. È importante sottolineare che l’ammina deve essere primaria altrimenti si formerebbe altro.
La reazione per formare le immine
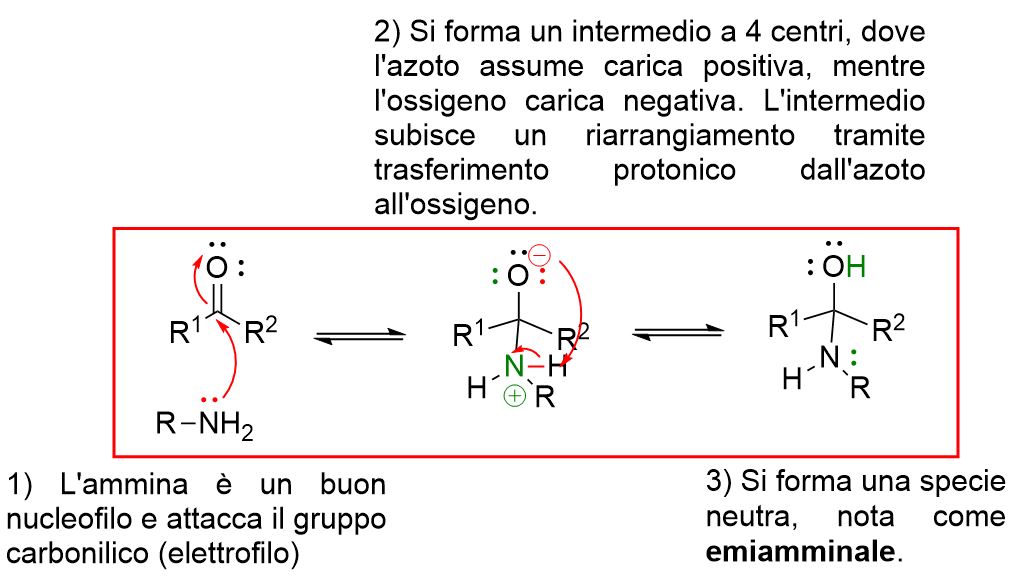
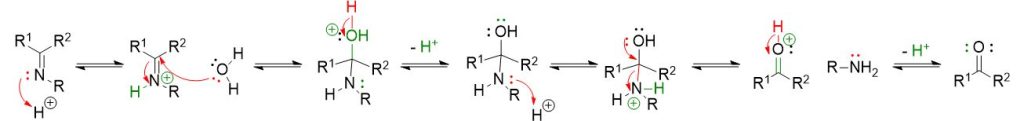
La reazione per formare le immine avviene per step tutti reversibili. Puoi vedere ogni step cliccando sui pulsanti a tendina in basso.
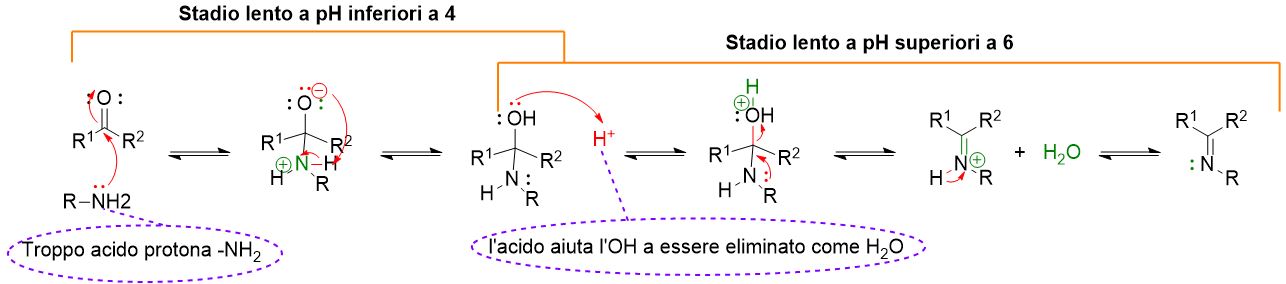
Come si può vedere dal meccanismo sopra descritto, il primo step coinvolge l’attacco nucleofilo dell’ammina primaria al carbonile per formare un intermedio neutro a 4 centri detto emiamminale.
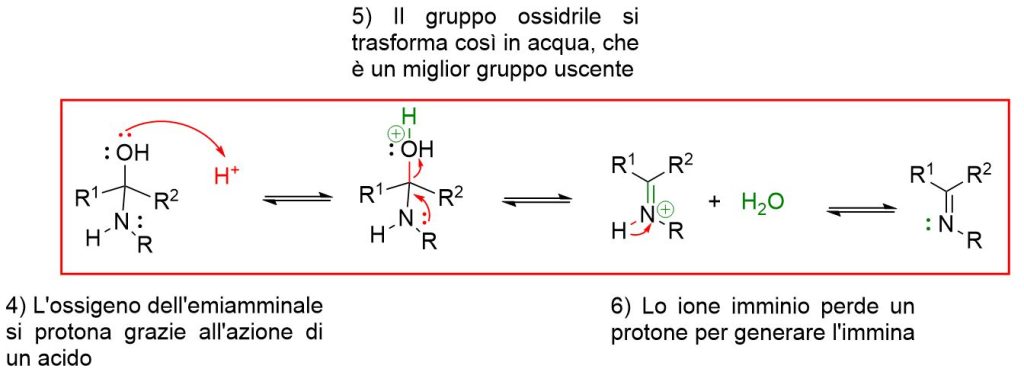
Nel secondo step, tuttavia interviene un acido per favorire l’eliminazione del gruppo OH, come acqua, e portare alla formazione dell’immina. Inoltre, siccome tutti gli step descritti sono di equilibrio, occorre spostare la reazione a destra per una conversione completa.
In sintesi, affinchè la formazione di un immina sia possibile occorre:
La catalisi acida per favorire la reazione nel secondo stadio tramite protonazione del gruppo ossidrile e sua trasformazione in acqua, un miglior gruppo uscente rispetto a OH–;
L’eliminazione dall’ambiente di reazione dell’acqua che si forma. Questo è necessario per spostare l’equilibrio a destra ed evitare la rigenerazione dei prodotti per idrolisi dell’immina (reazione di immina con acqua per dare di nuovo composto carbonilico e ammina primaria).
pH della reazione
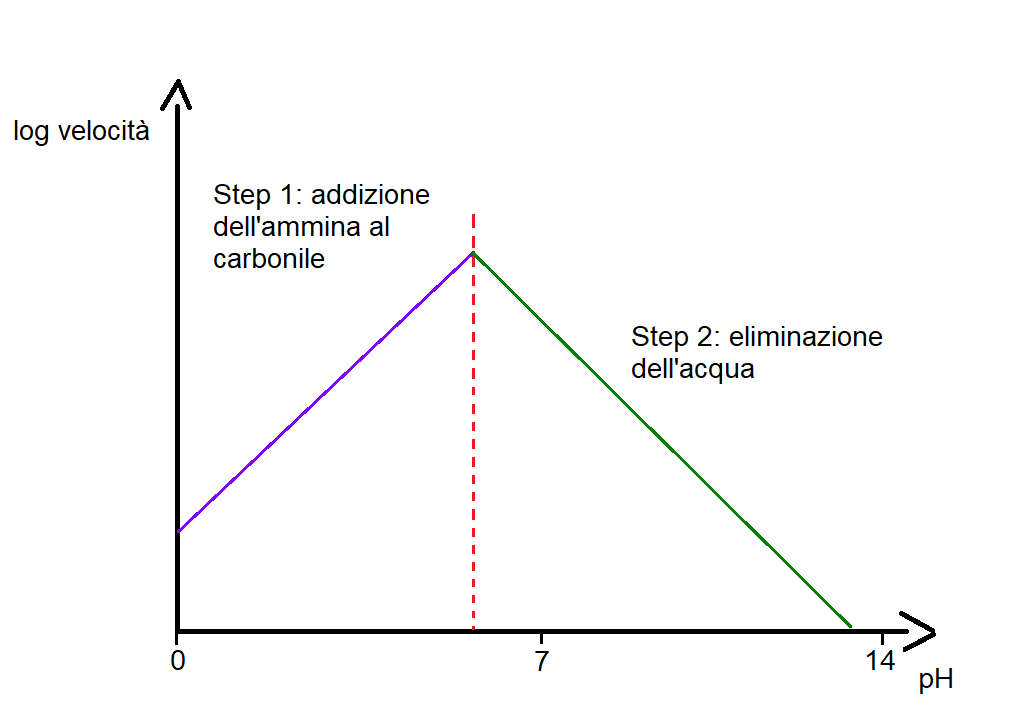
Come abbiamo visto nel meccanismo, il primo stadio della reazione avviene in condizioni di pH neutro. Tuttavia nel secondo stadio occorre una catalisi acida per spingere l’equilibrio verso i prodotti.
In particolare è stato visto che la reazione avviene più velocemente se il pH è nell’intervallo 4-6. A pH più acidi, inferiori a 4, la reazione rallenta, questo perchè a tali pH l’ammina primaria è tutta protonata e quindi la velocità del primo stadio di reazione rallenta (scorri le figure in basso). A pH più alti, sopra 6, la concentrazione di ioni H+ è troppo bassa per favorire la protonazione dell’OH e, quindi, il secondo stadio di reazione risulta rallentato.
Eliminazione dell’acqua
Come abbiamo visto, la reazione per formare l’immina è una reazione di equilbrio, quindi un modo per spingere la reazione a completamento, può sicuramente essere l’eliminazione di acqua dall’ambiente di reazione. Questo può essere raggiunto con le seguenti tecniche:
Uso della trappola di Dean-Stark;
Uso di sali igroscopici;
Uso di setacci molecolari.
Il primo metodo consiste nell’usare una speciale apparecchiatura nota come trappola di Dean-Stark, che puoi vedere nell’immagine sottostante.
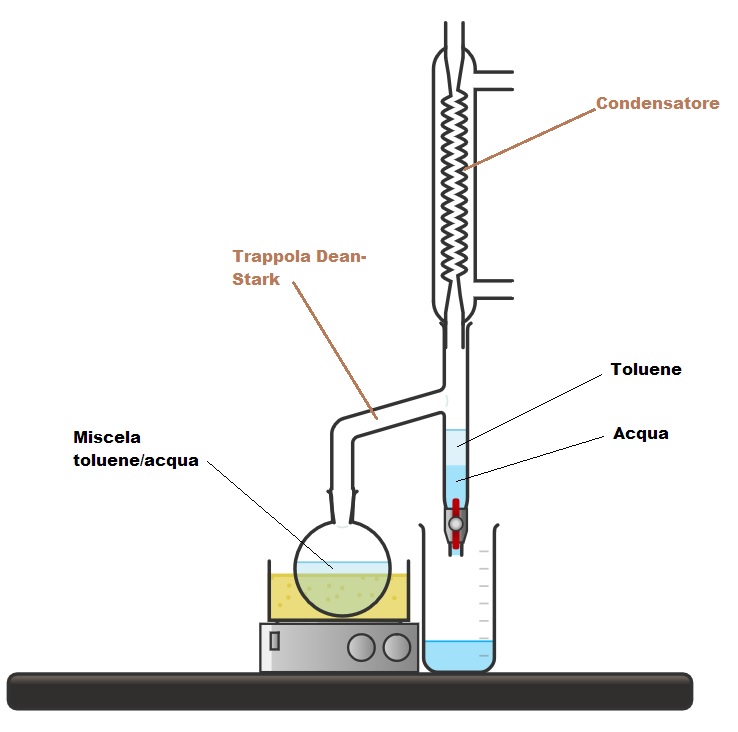
Questa trappola è un apparecchiatura in vetro composta da un tubo longitudinale e un tubo laterale obliquo. Il tubo longitudinale è formato da un’estremità superiore, alla quale si può collegare un refrigerante (o condensatore), e da un’estremità inferiore dotata di un rubinetto. Il tubo obliquo della trappola di Dean-Stark funge da collegamento con il pallone di reazione.
Il funzionamento della trappola si basa sull’uso di una miscela azeotropica, come ad esempio toluene/acqua, in cui avviene la reazione. Infatti, la reazione si svolge in riflusso, riscaldando la miscela alla temperatura di ebollizione dell’azeotropo toluene/acqua. In questo modo, la miscela evapora e, attraverso il braccio laterale della trappola di Dean-Stark, i vapori vengono indirizzati verso il refrigerante, che li condensa e li fa precipitare nella parte inferiore della trappola. Qui, i due solventi si separano in due fasi distinte grazie alla loro diversa densità: l’acqua forma la fase inferiore, mentre il toluene la fase superiore. Così, l’acqua può essere rimossa tramite il rubinetto, mentre il toluene ritorna nel pallone di reazione. La reazione si considera completata quando tutta l’acqua prevista è stata raccolta ed eliminata dall’ambiente di reazione.
Se non si dispone di una trappola di Dean-Stark, la reazione può essere eseguita aggiungendo sali igroscopici nel pallone di reazione, ossia sali in grado di assorbire l’acqua man mano che si forma. I sali più comunemente utilizzati in questo caso sono Na2SO4, MgSO4, silica gel, ecc.
Un’alternativa simile è l’uso di setacci molecolari, ossia materiali a base di zeoliti con porosità selettiva per l’eliminazione di piccole molecole. I setacci molecolari utilizzati per catturare l’acqua hanno pori con diametro di 3-4 Å (conosciuti commercialmente come 3A e 4A).
Stabilità immine
Come abbiamo ripetuto più volte in questo articolo, la reazione di formazione delle immine è reversibile. Questo implica che le immine, una volta formate, se incontrano acqua possono facilmente idrolizzarsi e tornare ad ammina primaria e composto carbonilico. Tale idrolisi spesso avviene anche senza catalisi basica o acida. La reazione di idrolisi è la reazione inversa alla formazione di un immina ed è indicata di seguito.
In generale possiamo dire che le immine più stabili sono quelle dove o l’atomo di C o quello di N recano un gruppo aromatico. Questo tipo di immine sono abbastanza stabili da poter essere isolate. Invece le immine derivanti dall’ammoniaca non possono essere isolate, perchè molto instabili; tuttavia sono rivelabili in soluzione. Infine, immine molto stabili sono quelle in cui l’atomo di N reca un gruppo elettronegativo: è il caso delle ossime, idrazoni e semicarbazoni, che puoi vedere nella figura in basso.
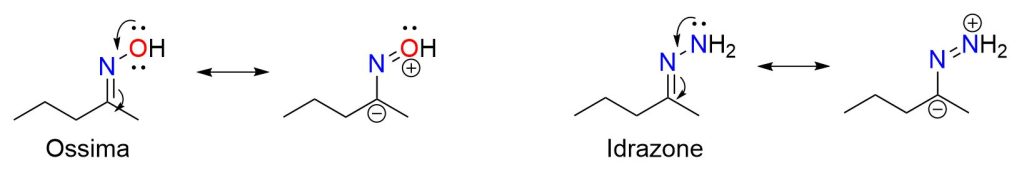
La stabilità di tali immine deriva dal fatto che il gruppo legato all’azoto partecipa alla delocalizzazione degli elettroni C=N, creando una struttura di risonanza con carina negativa sull’carbonio, che diventa quindi meno suscettibile di attacco nucleofilo.
Conclusione
Abbiamo visto in questo articolo come formare le immine. La reazione è reversibile e ha bisogno della rimozione di acqua per essere spinta verso i prodotti. Inoltre il pH ideale per la reazione è compreso tra 4-6. Se sei curioso di vedere come le immine vengano effettivamente create in laboratorio, puoi dare un’occhiata al nostro articolo che descrive le procedure tipiche effettuate dai nostri scienziati.