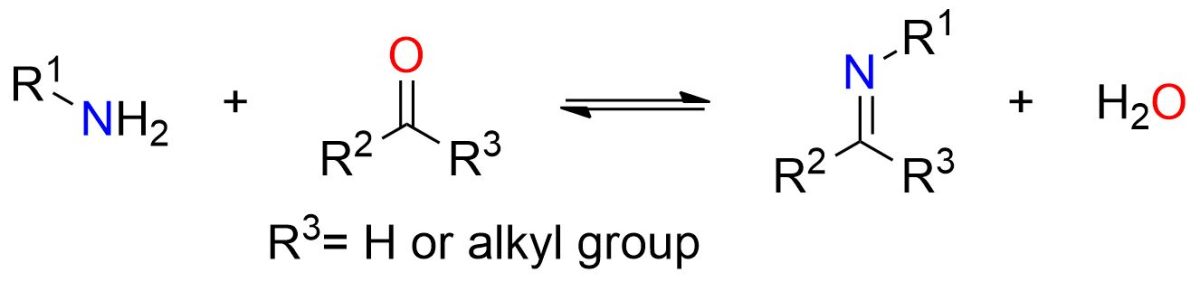Introduzione
In questo articolo vediamo le procedure tipicamente usate in laboratorio per formare le immine.
Prima di iniziare ricordiamo brevemente cos’è questa reazione.
La formazione di un’immina coinvolge la reazione tra un chetone o un’ aldeide con una ammina primaria.
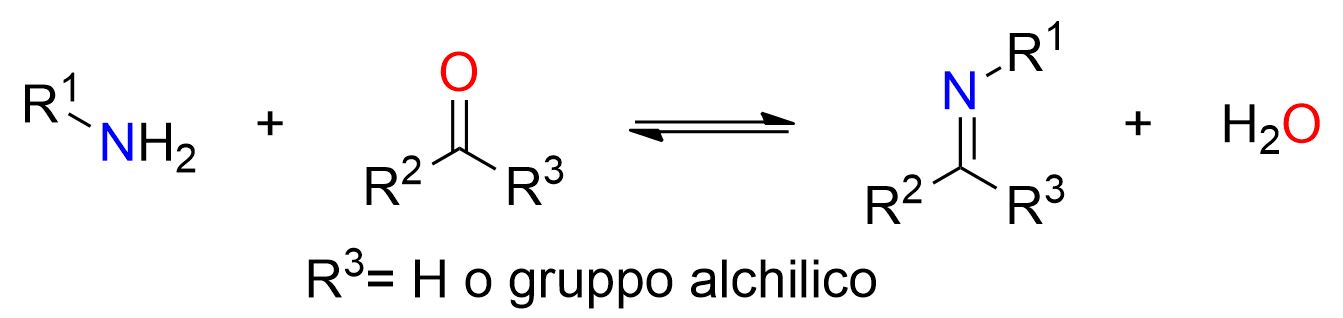
Lo schema sopra illustra nel suo complesso la reazione di formazione dell’immina. Tuttavia, la reazione procede attraverso più stadi, tutti reversibili. A causa della sua reversibilità, è necessario spostare l’equilibrio verso i prodotti selezionando con attenzione le condizioni di reazione, come spiegato di seguito.
Generiche condizioni di reazione
La formazione di un’immina è un processo reversibile; per questo motivo è necessario spostare l’equilibrio della reazione verso i prodotti utilizzando le seguenti strategie:
uso di un eccesso di immina;
eliminazione dell’acqua che si forma .
catalisi acida in genere o più raramente basica.
Queste strategie possono essere usate in combinazione o singolarmente.
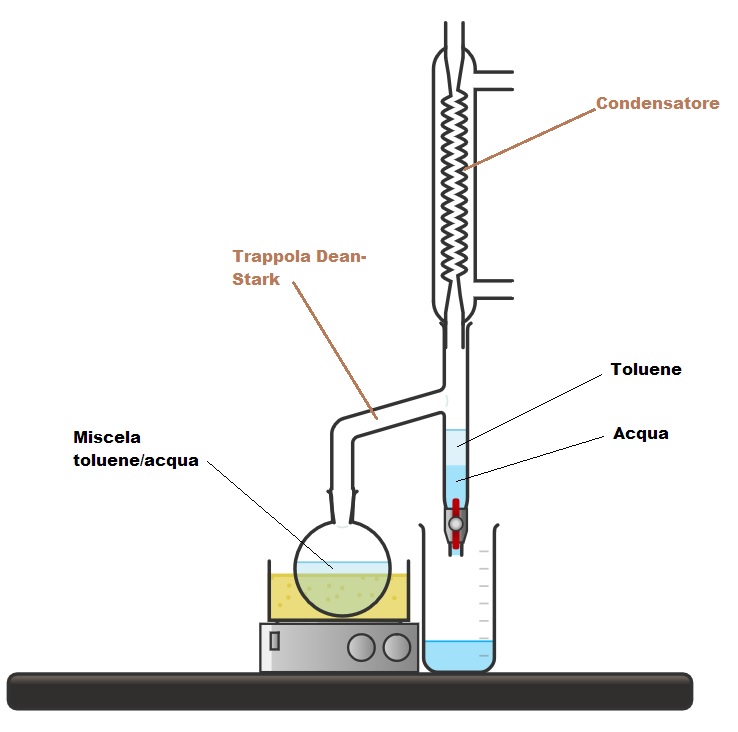
Per l’eliminazione dell’acqua dall’ambiente di reazione, si utilizza generalmente l’apparato di Dean-Stark (vedi figura in basso), che permette di distillare l’acqua dal sistema sfruttando l’azeotropo toluene-acqua. Tuttavia, in assenza di tale apparato, è possibile ricorrere ad altri metodi per rimuovere l’acqua, come l’impiego di sali igroscopici (ad es. Na₂SO₄, MgSO₄, silica gel, ecc.) o l’uso di setacci molecolari.
La catalisi acida viene generalmente effettuata aggiungendo quantità catalitiche di acidi come l’acido para-toluensolfonico, l’acido cloridrico, l’acido acetico, ecc. L’aggiunta dell’acido ha lo scopo di rendere il gruppo carbonile del chetone o dell’aldeide più elettrofilo e di facilitare l’uscita dell’ossigeno carbonilico sotto forma di acqua, a seguito della protonazione.
La reazione è generalmente catalizzata da acidi, ma esistono esempi in letteratura di catalisi basica. Le basi più comunemente utilizzate a questo scopo sono K₂CO₃, NaOH, NaHCO₃, KF, ecc.
Procedure tipiche
Dopo aver discusso le caratteristiche generali della formazione delle immine, vediamo infine come eseguire la reazione in laboratorio. Di seguito sono riportate alcune procedure tipiche presenti in letteratura, suddivise a seconda del metodo usato per favorire la reazione (trappola di Dean-Stark, setacci molecolari, sali igroscopici, catalisi acida, catalisi basica).
Procedure con l’apparato di Dean-Stark
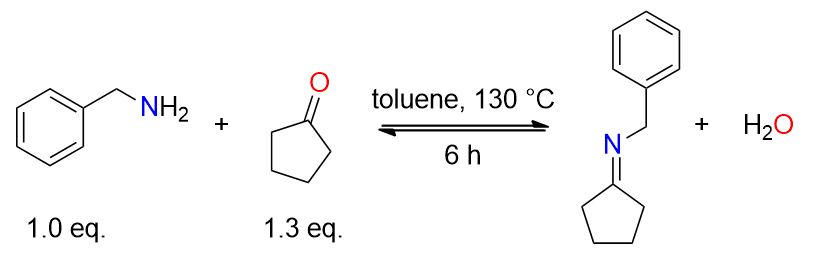
Una miscela di cicloeptanone (1,43 mL, 12,1 mmol) e benzilammina (1,02 mL, 9,33 mmol) in 30 mL di toluene è stata riscaldata a riflusso per 6 ore usando l’apparato di Dean-Stark per la rimozione dell’acqua. Il residuo ottenuto è stato concentrato sotto pressione ridotta e utilizzato direttamente per le reazioni successive. [1]
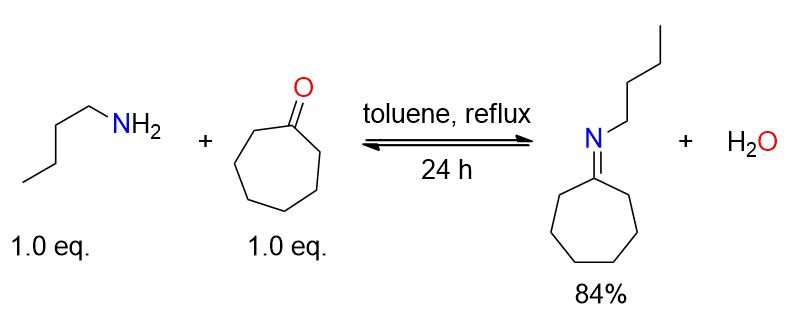
Un pallone equipaggiato con un apparato di Dean-Stark è stato caricato con cicloesanone (10,36 mL, 0,1 mol), 1-butilammina (9,98 mL, 0,1 mol) e 15 mL di toluene. La miscela è stata riscaldata a riflusso e agitata per 24 ore. La soluzione è stata poi distillata (64°C, 2 mmHg), ottenendo N-cicloesilidenbutilammina (12,8 g, 84%) come olio incolore.[2]
Procedures con setacci moleculari
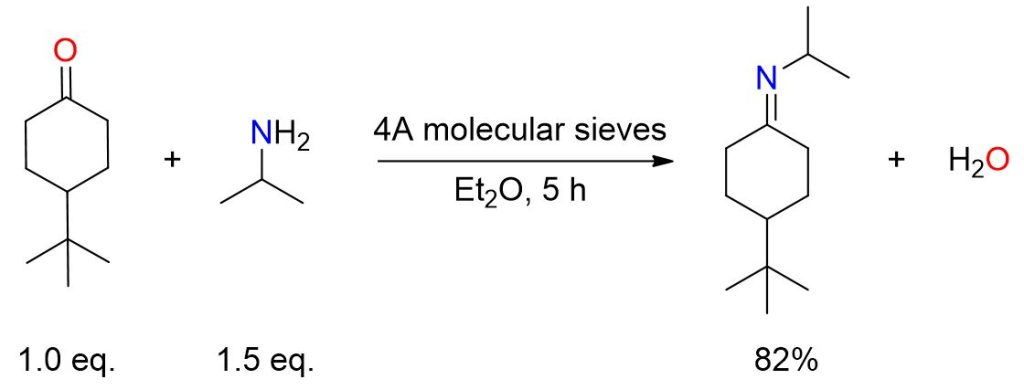
Una miscela contenente 20 mmol di 4-tert-butilcicloesanone in 15 mL di etere anidro e 8 g di setacci molecolari 4A, è stata fatta reagire con 30 mmol di isopropilammina. La soluzione è stata mescolata per 5 ore, quindi filtrata e i setacci sono stati risciacquati con tre porzioni di etere da 3 mL ciascuna. Le soluzioni di etere unite sono state quindi concentrate. Infine, la distillazione bulb-to-bulb del residuo risultante ha fornito un’immina con una resa dell’82%, punto di ebollizione 65-70 °C (0,1 Torr).[3]
Procedure con sali igroscopici
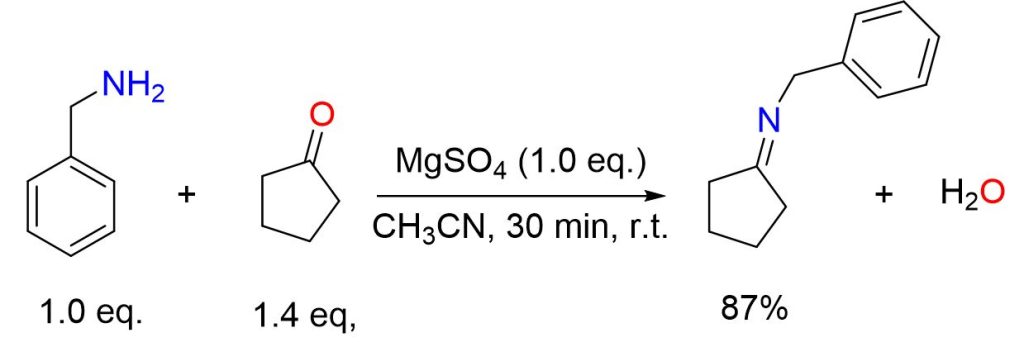
Una soluzione di ciclopentanone (2,47 mL, 28 mmol), benzilammina (2,18 mL, 20 mmol) e MgSO4 (2,4 g, 20 mmol) in CH3CN (30 mL) è stata agitata a temperatura ambiente per 30 minuti. Successivamente, il MgSO4 è stato rimosso tramite filtrazione e il solvente è stato evaporato, lasciando un olio giallo (3 g, resa dell’87%).[4]
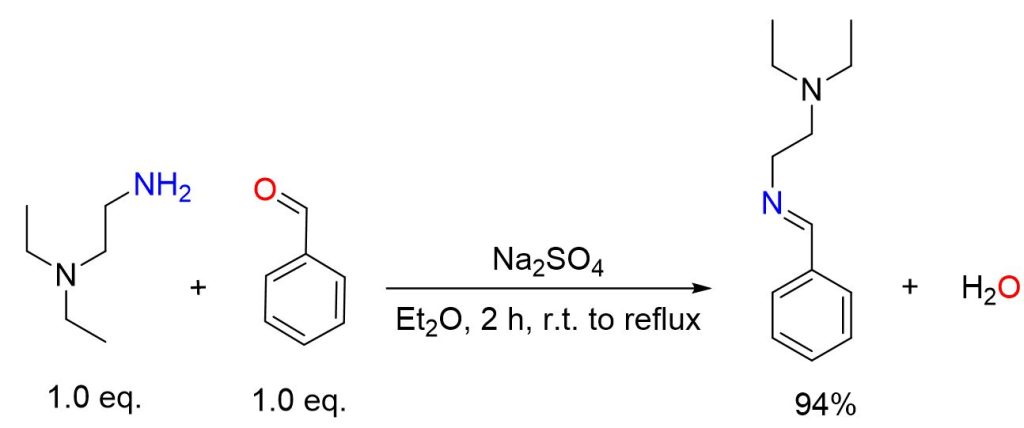
Benzaldeide (5,30 g, 50,0 mmol) e N,N-dietiletilenediammina (5,81 g, 50,0 mmol) sono stati disciolti in etere dietilico e agitati con solfato di sodio per un’ora a temperatura ambiente, seguiti da un’ulteriore ora sotto riflusso. La miscela di reazione è stata poi filtrata e il solvente è stato eliminato utilizzando un evaporatore rotante. Successivamente, il prodotto è stato essiccato sotto vuoto utilizzando una pompa ad olio (9,60 g, 47,0 mmol, resa del 94%). [5]

La (3-clorofenil)metanamina (1 eq.) è stata aggiunta a una soluzione di estere tert-butile dell’acido 4-osso-piperidine-1-carbossilico (1 eq.) in toluene (0,65 M), seguita dall’aggiunta di SiO₂ (rapporto in peso 1:1 rispetto alla 4-osso-piperidina). Questa miscela è stata agitata per tutta la notte e successivamente utilizzata per ulteriori trasformazioni.[6]
Procedure con catalizzatore acido
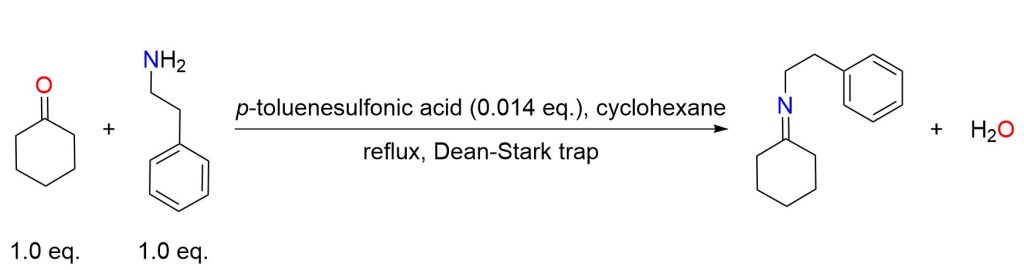
Una miscela di cicloesanone (9,8 g, 0,100 mol), feniletilammina (12,1 g, 0,100 mol) e acido p-toluenesolfonico (250 mg) in cicloesano (100 mL) è stata riscaldata a riflusso, mantenendo il riscaldamento fino a quando 1 equivalente di acqua è stata raccolta in un apparecchio di Dean-Stark. Il solvente è stato poi rimosso dalla reazione e il residuo rimanente è stato distillato (140 °C a 0,3 mmHg), ottenendo l’intermedio immina come un olio incolore (19 g, resa del 95%). [7]
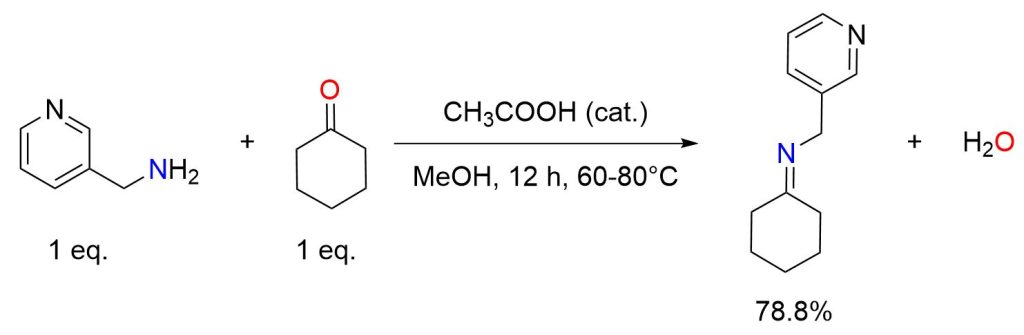
Una soluzione metanolica di 3-aminometil piridina (0,05 mol) è stata posta in un pallone da 250 mL. A questa è stata aggiunta lentamente una soluzione metanolica equimolare (0,05 mol) di cicloesanone, insieme a qualche goccia di acido acetico glaciale per acidificare leggermente la miscela di reazione. La miscela è stata agitata per 12-15 ore a 60-80°C utilizzando un agitatore magnetico. Il progresso della reazione è stato monitorato tramite cromatografia su strato sottile (TLC). Al termine della reazione, circa la metà del solvente è stata evaporata e la soluzione rimanente è stata lasciata a cristallizzare. La ricristallizzazione è stata quindi effettuata con etanolo, ottenendo l’immina con una resa del 78,8%. [8]
Procedure con catalizzatore basico
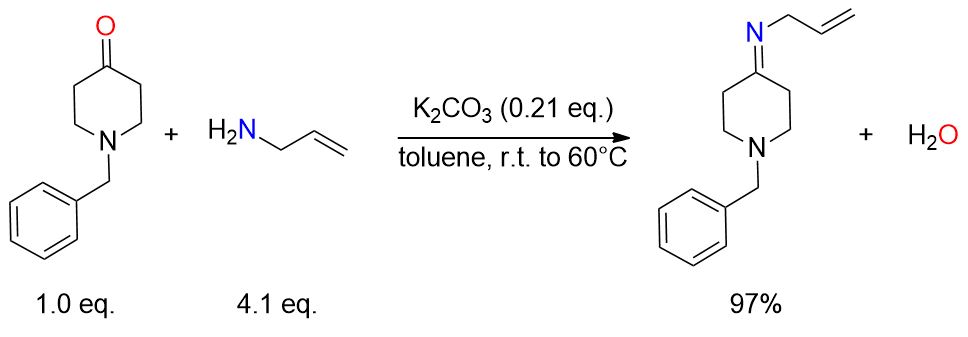
1-Benzil-4-piperidone (16 g, 84 mmol) e K2CO3 anidro (24,3 g, 17,6 mmol) sono stati mescolati in toluene (160 mL) sotto un’atmosfera di azoto. L’allilammina (26 mL, 347 mmol, 4 equivalenti) è stata aggiunta a temperatura ambiente. La miscela risultante è stata mescolata per tutta la notte a 60 °C, quindi filtrata ed evaporata per ottenere l’immina (18,78 g, 97%). [9]
Riferimenti
[1] Monaco, A., Szulc, B. R., Rao, Z. X., Barniol‐Xicota, M., Sehailia, M., Borges, B. M. A., & Hilton, S. T. (2017). Short total synthesis of (±)‐Γ‐Lycorane by a sequential intramolecular acylal cyclisation (IAC) and intramolecular heck addition reaction. Chemistry – a European Journal, 23(20), 4750–4755. https://doi.org/10.1002/chem.201700143
[2] Kusakabe, K., Iso, Y., Tada, Y., Sakagami, M., Morioka, Y., Chomei, N., Shinonome, S., Kawamoto, K., Takenaka, H., Yasui, K., Hamana, H., & Hanasaki, K. (2013). Selective CB2 agonists with anti-pruritic activity: Discovery of potent and orally available bicyclic 2-pyridones. Bioorganic & Medicinal Chemistry, 21(11), 3154–3163. https://doi.org/10.1016/j.bmc.2013.03.030
[3] Fraser, R. R., Banville, J., Akiyama, F., & Chuaqui-Offermanns, N. (1981). 13C shieldings in syn and anti aldimines and ketimines. Canadian Journal of Chemistry, 59(4), 705–709. https://doi.org/10.1139/v81-102.
[4] Baxendale, I. R., Hornung, C., Ley, S. V., De Mata Muñoz Molina, J., & Wikström, A. (2012). Flow microwave technology and microreactors in synthesis. Australian Journal of Chemistry, 66(2), 131. https://doi.org/10.1071/ch12365
[5] Specht, P., Petrillo, A., Becker, J., & Schindler, S. (2021). Aerobic C−H hydroxylation by Copper imine complexes: The Clip‐and‐Cleave Concept – Versatility and Limits. European Journal of Inorganic Chemistry, 2021(20), 1961–1970. https://doi.org/10.1002/ejic.202100185
[6] Rudolph, D. A., Dvorak, C. A., Dvorak, L., Nepomuceno, D., Bonaventure, P., Lovenberg, T. W., & Carruthers, N. I. (2010). Novel tetrahydropyrido[3,2-c]pyrroles as 5-HT7 antagonists. Bioorganic & Medicinal Chemistry Letters, 21(1), 42–44. https://doi.org/10.1016/j.bmcl.2010.11.078.
[7] Gray, N. M., Cheng, B. K., Mick, S. J., Lair, C. M., & Contreras, P. C. (1989). Phencyclidine-like effects of tetrahydroisoquinolines and related compounds. Journal of Medicinal Chemistry, 32(6), 1242–1248. https://doi.org/10.1021/jm00126a016.
[8] Pandey, S., & Srivastava, R. S. (2010). Synthesis and characterization of some heterocyclic schiff bases: potential anticonvulsant agents. Medicinal Chemistry Research, 20(7), 1091–1101. https://doi.org/10.1007/s00044-010-9441-z.
[9] Jenkins, I. D., Lacrampe, F., Ripper, J., Alcaraz, L., Van Le, P., Nikolakopoulos, G., De Almeida Leone, P., White, R. H., & Quinn, R. J. (2008). Synthesis of four novel natural product inspired scaffolds for drug discovery. The Journal of Organic Chemistry, 74(3), 1304–1313. https://doi.org/10.1021/jo802456w.