Cosa sono gli atomi?
In questo articolo impareremo cosa sono gli atomi e come sono fatti. Ma iniziamo subito a chiederci cosa vuol dire la parola atomo.
La parola atomo, dal gr. átomos, significa indivisibile
giacché si pensava fosse la più piccola unità che costituiva la materia e così credeva anche il povero Dalton.
Le particelle che compongono l’atomo
Oggi invece sappiamo che l’atomo è costituito a sua volta da particelle più piccole. Consiste infatti di un piccolo e pesante nucleo di neutroni e protoni, e da una nube di elettroni leggeri che si muovono attorno. Il nucleo infatti è molto piccolo; occupa solo un milionesimo di miliardesimo dell’intero volume dell’atomo e siccome esso detiene la maggior parte della massa dell’intero atomo, significa che è molto denso (la massa del nucleo è 1800 volte superiore a quella di un elettrone), mentre il restante volume dell’atomo è fatto in massima parte di spazio vuoto (vedi Figura 1).
Paragonando un atomo con una stanza, il nucleo avrebbe le dimensioni di una briciola, mentre gli elettroni si muoverebbero rasentando i muri.
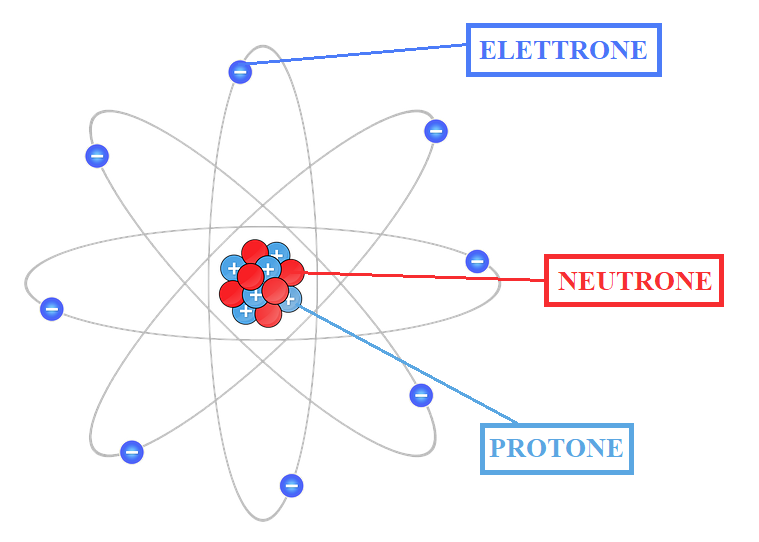
Protoni e elettroni sono particelle cariche, la cui carica è uguale ma di segno opposto (1,602 × 10-23 C). Infatti i protoni hanno carica positiva, mentre gli elettroni carica negativa. I neutroni invece sono particelle neutre ma di massa comparabile a quella dei protoni (1,67 × 10-24 g); la massa degli elettroni è invece 9,11×10-28g.
Gli atomi: simboli e numeri
Per distinguere i vari tipi di atomi si usano dei simboli chimici, che consistono di una o due lettere che provengono sovente dall’iniziale del nome latino o greco dell’atomo in questione. Ad esempio la parola idrogeno deriva dal greco hýdor, “acqua”, e ghennáo, “generare”, ossia “generatore d’acqua”; il simbolo chimico relativo all’atomo di idrogeno è H, dall’iniziale della parola greca. Allo stesso modo l’atomo di elio, deriva dalla parola greca hélios, “sole”, perciò il simbolo chimico che lo contraddistingue sono le iniziali della parola greca: He. E così via per gli altri elementi.
Per sapere i simboli chimici degli atomi, ti basterà guardare la Tavola Periodica dove essi sono elencati e potrai impararli a memoria!
Guardando la Tavola Periodica, però, potrai anche notare che gli atomi oltre a essere contraddistinti dal simbolo chimico, sono caratterizzati anche da numeri. Infatti il modo corretto di rappresentare un atomo è di scrivere il simbolo chimico con due numeri uno all’apice e l’altro a pedice (Figura 2).

Questi due numeri sono rispettivamente il numero di massa (A, apice) e il numero atomico (Z, pedice). Ma cosa sono questi due numeri?
- Il numero atomico (Z) è il numero di protoni, in base al quale gli atomi sono classificati all’interno della tavola periodica; infatti atomi con lo stesso numero atomico appartengono allo stesso elemento.
- Il numero di massa (A) invece è il numero totale di neutroni e protoni.
Dunque il numero atomico è molto importante perché identifica quel determinato tipo di atomo. Si chiama numero atomico, appunto perché è un numero identificativo di quell’atomo, un po’ come il nostro codice fiscale identifica una persona. Il numero di massa, invece, ci dà solo un’informazione aggiuntiva e relativa al numero totale di neutroni e protoni e si chiama così proprio perché è l’insieme di protoni e neutroni a dare il grosso della massa all’atomo, dato che gli elettroni, invece, pesano molto meno.
Ioni e isotopi
Il numero atomico e il numero di massa sono molto utili anche per identificare e definire gli ioni e gli isotopi.
Gli ioni
Iniziamo a parlare degli ioni.
In un atomo neutro il numero di protoni è uguale a quello degli elettroni, dato che la carica dell’elettrone è uguale ma di segno opposto a quella del protone. Dunque in un atomo neutro Z, oltre a indicare il numero di protoni, indica anche il numero di elettroni.

Tuttavia gli atomi possono perdere degli elettroni o li possono acquisire, in tal caso Z indicherà solo il numero di protoni, perché ora il numero di elettroni è cambiato. In questo caso, non si parla più di atomo ma di ione. Infatti:
- Gli atomi con un numero diverso di elettroni e protoni acquistano una carica e sono definiti ioni.

Uno ione che ha acquistato elettroni si chiama ANIONE e assume carica negativa. Viceversa uno ione che perde elettroni si chiama CATIONE e assume carica positiva.
Facciamo un esempio, se l’idrogeno perde il suo unico elettrone diventerà carico positivamente e verrà indicato con il simbolo: H+. In tale catione Z è sempre pari a 1, ma questa volta il numero di elettroni è pari a 0 (Figura 3).

Similmente, se l’ossigeno acquista due elettroni diventerà carico due volte negativamente e si indicherà con il simbolo: O2-. In tale anione Z è sempre uguale a 8, ma il numero di elettroni non è più 8, ma 10, per via dei due in più acquisiti dall’atomo (Figura 4).

Gli isotopi
Passiamo ora a capire cosa sono gli isotopi.
Esistono atomi con lo stesso numero di protoni (Z è uguale) ma diverso numero di neutroni (A diverso), ossia atomi che appartengono allo stesso elemento, ma hanno massa diversa a causa di un numero minore o maggiore di neutroni. Tali atomi si dicono isotopi (dal greco “stesso posto”). Riassumendo, due atomi si dicono isotopi quando:
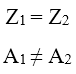
Gli isotopi avendo lo stesso numero di elettroni manifestano le stesse proprietà chimiche, ma non le stesse proprietà fisiche, dato che i loro atomi hanno masse diverse.
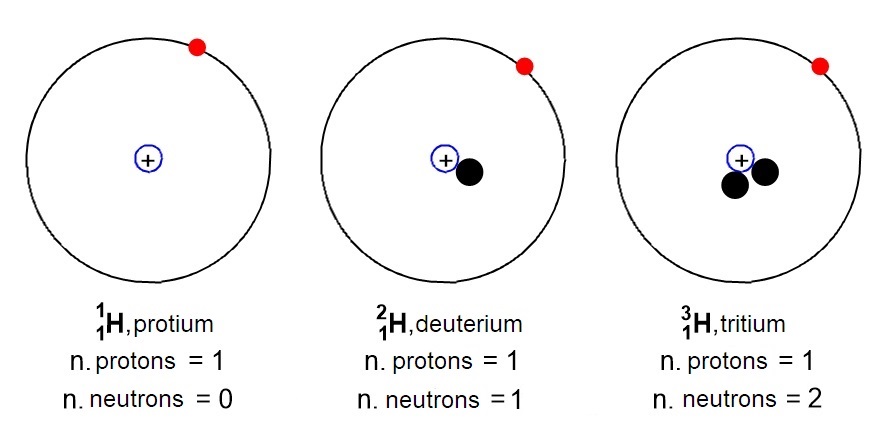
L’idrogeno, ad esempio, si trova in natura in tre forme isotopiche (Figura 5): idrogeno comune (o prozio) con un solo protone e zero neutroni, idrogeno pesante (o deuterio) con un protone e un neutrone e idrogeno radioattivo (o trizio) con un protone e due neutroni.
Gli isotopi sono molto importanti perché influenzano la massa di un atomo. Infatti, siccome abbiamo capito che un atomo si può presentare in varie forme isotopiche, questo implica che quel determinato atomo può avere masse differenti a seconda di quanti neutroni avrà in più o in meno. Dunque come calcolare la massa di un atomo, se essa varia con gli isotopi?
La massa di un atomo è calcolata come media ponderata (in base alla percentuale di abbondanza isotopica) di tutti gli isotopi di quell’elemento. L’abbondanza isotopica è espressa in percentuale e quindi equivale al numero di atomi di un determinato isotopo su 100 atomi della miscela isotopica. Ad esempio su 100 atomi dell’elemento carbonio, 98,90 atomi sono 12C, carbonio 12, e 1,10 atomi sono costituiti da carbonio 13, 13C. Esempi di abbondanze isotopiche di alcuni elementi sono riportate di seguito.

Per concludere questo articolo facciamo solo un esempio di come calcolare il peso atomico di un elemento. Prendiamo come esempio il carbonio, come si vede dalla tabella in alto, il carbonio esiste come 12C con abbondanza di 98.90 % e come 13C con abbondanza di 1.10 %. Tuttavia per calcolare il peso atomico del carbonio occorre sapere il peso di ciascun isotopo: il peso del 12C è 12.00000 u mentre il 13C è 13.00335 u. Ora occorre solo effettuare la media ponderata dei due isotopi per ottenere il peso atomico del carbonio:

Questa lezione

Gli atomi
€
1.50
Scarica pdf (non modificabile)

Gli atomi
€
2.20
Scarica docx (modificabile)

