Cosa studia la chimica?
Che cosa studia la chimica?
Questa è certamente la prima domanda da porsi all’inizio dei nostri studi, ma è anche una domanda che con il passare del tempo, riusciremo a capire più a fondo e a integrare in tutte le sue parti, via via che scopriremo i vari campi in cui la chimica opera. Ma ora vediamo la definizione classica.
La chimica studia la materia e le sue trasformazioni
giacché la materia non è qualcosa di statico, ma è mutabile; basti pensare alle reazioni chimiche o anche semplicemente ai passaggi di fase in seguito a cambiamenti di temperatura o pressione. E se tutto fosse sempre uguale, noi chimici ci annoieremmo presto. Non vedremmo la magia delle trasformazioni: pensate ad esempio ai fuochi d’artificio, dove gli elementi si divertono a emettere luci colorate e allietano le nostre feste. Dunque il termine trasformazione tenetelo bene in testa!

Che cos’è la materia?
Abbiamo detto che la chimica studia la materia e la sua trasformazione. Dunque per capire meglio la definizione di chimica non ci resta che definire bene anche il concetto di materia:
la materia è tutto ciò che ha una massa e occupa uno spazio.
Essa è tutto ciò che vediamo e tocchiamo, pensiamo alle rocce, all’acqua, al cibo, alle persone, ma anche tutto ciò che non possiamo vedere, pensate ad alcuni gas incolori, come ad esempio il monossido di carbonio. Questo è un gas in cui non vi auguro di imbattervi dato che è letale e neppure si sente all’olfatto. È un assassino che si nasconde bene.
Per ricordare il concetto di materia come qualcosa con massa e spazio, possiamo pensare a un panino del McDonald, la cui M ci può ricordare il concetto di massa, ossia peso, e il fatto di mangiarlo ci può far ricordare che occuperà un bel po’ di spazio nel nostro stomaco! Non è sicuramente un tipo di materia salutare, ma è certamente un esempio calzante.

Le sostanze: elementi e composti
Ora abbiamo capito che la materia è un concetto abbastanza generale, che racchiude tutti i materiali intorni a noi. Tuttavia è possibile riconoscere delle parti della materia che sono molto più specifiche e individuabili. Un esempio è il concetto si sostanza. Vediamone la definizione.
Una sostanza è un’unica e pura forma della materia. Dove il termine puro si riferisce alla scala microscopica. Ossia la sostanza non è una miscela di più tipi di materia, come la spazzatura o la carne, ma è un unico tipo di materia come l’acqua o il ferro.
Una sostanza può essere formata da semplici elementi o da composti.
Gli elementi
La definizione di elemento, come oggi si intende nel mondo della chimica, fu data da Dalton per la prima volta. Egli misurando la massa dei reagenti e dei prodotti delle reazioni chimiche, notò che c’era qualcosa di definito nei rapporti con cui le sostanze reagivano tra loro. Dunque ciò poteva essere spiegato solo ammettendo che la materia non ha carattere continuo, ma è costituita da particelle minuscole: gli atomi. Da qui la definizione di elemento:
- Un elemento è una sostanza, costituita da un’unica specie di atomi. Un elemento è quindi una sostanza elementare formata da atomi aventi tutti lo stesso numero atomico (ossia lo stesso numero di protoni).
Gli elementi chimici sono classificati nella Tavola periodica in base al loro numero atomico e sono indicati attraverso simboli specifici. Gli elementi sono oltre 100, 90 naturali e 21 di origine sintetica. Le sostanze elementari si presentano in vari modi in base alla loro reattività: atomi isolati (come per i gas nobili) o unità discrete di atomi legati tra loro, le molecole (es. O2, Br2, P4, S8), un insieme continuo di atomi legati con legami covalenti, ossia sostanze polimere (come il boro, il silicio, il carbonio nella grafite e nel diamante) o con legami di tipo metallico, ossia sostanze metalliche (es. sodio, ferro, rame, zinco, ecc.) . La tabella (Tabella 1) sottostante chiarifica i suddetti casi.
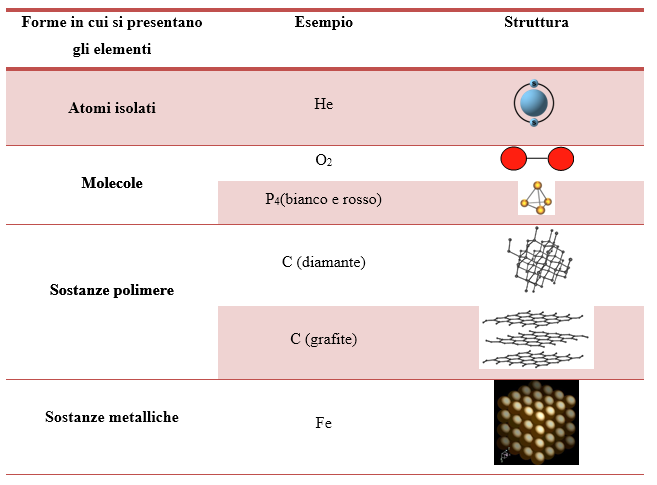
I composti
Rientrano nella classificazione di sostanza, non solo gli elementi, ma anche i composti.
I composti sono sostanze formate dalla combinazione di due o più elementi in proporzione definita e costante.
Tale definizione deriva dalla legge di Proust del 1799 (legge delle proporzioni definite e costanti) secondo cui: “quando due o più elementi reagiscono, per formare un determinato composto, si combinano sempre secondo proporzioni in massa definite e costanti”. Ad esempio l’acqua è formata da due elementi: idrogeno e ossigeno; tali elementi in questa sostanza però sono tali da rispettare sempre il rapporto due atomi di idrogeno per ogni atomo di ossigeno. Ciò che brevemente si sintetizza nella formula molecolare H2O.
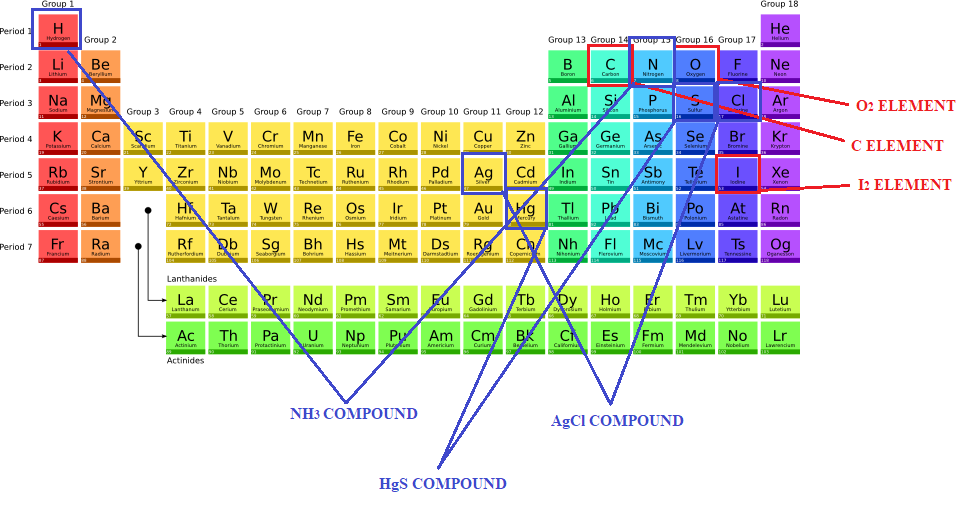
Per ricapitolare, gli elementi e i composti sono entrambi sostanze. Tuttavia gli elementi sono fatti da un solo tipo di atomi, mentre i composti sono la combinazione di più atomi diversi tra loro. In altre parole gli elementi sono quelle sostanze identificate da una formula chimica il cui simbolo lo si trova in una sola casella della tavola periodica (vedi Figura 1) al più con un numero da aggiungere in basso per indicare quanti atomi si combinano tra loro: H2, O2, Cl2, P4, S8 etc. Mentre i composti sono rappresentati da delle formule chimiche che comprendono simboli derivanti da due o più caselle della tavola periodica con numeri in basso a indicare le proporzioni con cui si combinano: H2O indica l’acqua, formata sia dall’elemento idrogeno H che dall’elemento ossigeno O.
I composti quindi sono molto di più degli elementi perché derivano dalle combinazioni di tutti gli elementi della tavola periodica in proporzioni diverse, dunque le possibilità sono potenzialmente infinite.
Come gli elementi si possono trovare in varie forme, così anche i composti; i quali si suddividono in:
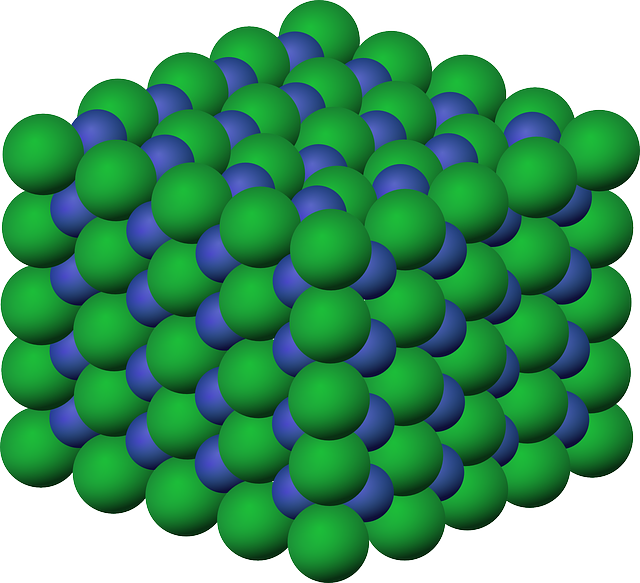
- Composti ionici: formati da ioni positivi e negativi che interagiscono tra loro per attrazione elettrostatica in modo che il composto nella sua interezza sia elettricamente neutro. In tali composti non è possibile individuare unità discrete, le molecole, perché ogni ione è circondato da altri di carica opposta; tuttavia dato che sono rispettate sempre delle proporzioni tra ioni positivi e negativi, si usano i rapporti per definire tali sostanze, ossia si usa la formula elementare o empirica. Esempi sono NaCl (rapporto di 1:1 tra ione sodio e cloruro) MgCl2, CaCl2 (rapporto di 1:2 tra lo ione del metallo alcalino terroso e lo ione cloruro). Tutti i composti ionici sono solidi.
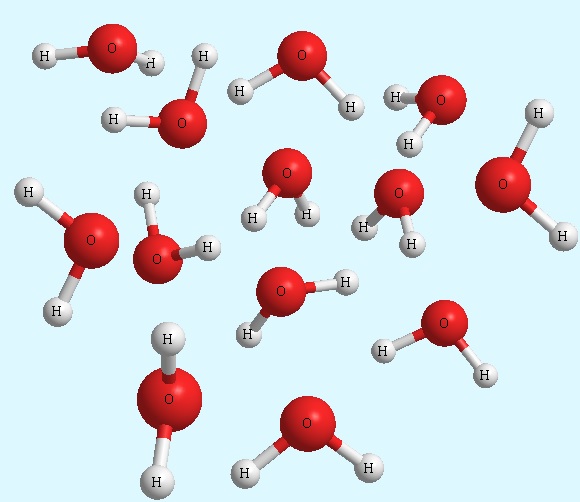
- Composti molecolari: sono sostanze costituite da molecole; dove per molecola si intende un raggruppamento di atomi legati tra loro in modo definito, distinto ed elettricamente neutro. Sono per lo più liquidi o gassosi. Difficilmente sono solidi, ma se lo sono fondono a temperature basse. Essi sono espressi mediante la formula molecolare che dice esattamente quanti atomi ci sono in ogni molecola. Un esempio è l’acqua espressa con la formula H2O, la quale afferma che in una molecola di acqua ci sono sempre due atomi di idrogeno e uno di ossigeno.
Questa lezione

Introduzione alla chimica
€
1.50
Scarica pdf (non modificabile)

Introduzione alla chimica
€
2.20
Scarica docx (modificabile)

