Le strutture di Lewis sono un problema?
Trovi qui 5 esercizi svolti sulle strutture di Lewis
Puoi leggere anche il nostro precedente articolo Le strutture di Lewis per capire le regole che bisogna usare per fare gli esercizi.
Determinare la formula di struttura di N2
Per risolvere l’esercizio seguiamo le 5 regole scritte precedentemente:
1) Contiamo gli elettroni di valenza di tutti gli atomi e dividiamo per due.

2) Non c’è atomo centrale perché la molecola è binaria.
3) Calcoliamo le coppie di elettroni impegnate nei legami. In questo caso i due atomi di N seguono la regola dell’ottetto, quindi intorno a loro dovranno avere 2×8 = 16 elettroni per seguire la regola dell’ottetto. 16 elettroni sono pari a 8 coppie di elettroni. Il numero di legami tra i due N è dato dalla differenza tra gli elettroni dell’ottetto e quelli totali di valenza. Quindi abbiamo:

Dunque iniziamo a scrivere la prima bozza di struttura:

4) Disponiamo le restanti coppie di elettroni di valenza come coppie di elettroni solitarie, di modo che ogni atomo segua la regola dell’ottetto. Siccome delle 5 coppie di valenza a disposizione, 3 sono state usate per i legami, restano 2 coppie da sistemare. Queste due coppie andranno una su ciascun atomo di N, di modo che ogni N abbia 8 elettroni intorno a sé.

Questa è la struttura finale della molecola. Non occorre andare alla regola 5, perché non ci sono strutture di risonanza di uguale stabilità. Inoltre è inutile calcolare le cariche formali (regola 6), perché non abbiamo dubbi con altre strutture.
Determinare la formula di struttura di OF2
- Contiamo gli elettroni di valenza di tutti gli atomi e dividiamo per due.

- L’ atomo centrale è l’ossigeno perché meno elettronegativo.
- Calcoliamo le coppie di elettroni impegnate nei legami. In questo caso tutti e 3 gli atomi seguono la regola dell’ottetto, quindi intorno a loro dovranno avere 3×8 = 24 elettroni per seguire la regola dell’ottetto. 24 elettroni sono pari a 12 coppie di elettroni. Il numero di legami tra O e F è dato dalla differenza tra le coppie di elettroni totali dell’ottetto e quelle totali di valenza. Quindi abbiamo:
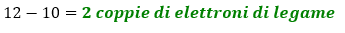
Dunque iniziamo a scrivere la prima bozza di struttura:

- Disponiamo le restanti coppie di elettroni come coppie di elettroni solitarie, di modo che ogni atomo segua la regola dell’ottetto. Siccome delle 10 coppie a disposizione, 2 sono state usate per i legami, restano 8 coppie da sistemare. Queste 8 coppie andranno 2 sull’ossigeno, che così raggiungerà l’ottetto e le restanti 6 sui due fluori. La struttura diventa allora:

Questa è la struttura finale della molecola. Non occorre andare al punto 5, perché non ci sono strutture di risonanza, in quanto non ci sono doppi legami. Inoltre è inutile calcolare le cariche formali (regola 6), perché non abbiamo dubbi con altre strutture.
Determinare la formula di struttura di HCN
- Contiamo gli elettroni di valenza di tutti gli atomi e dividiamo per due.

- L’ atomo centrale è il carbonio perché meno elettronegativo rispetto all’azoto. Tuttavia ha elettronegatività leggermente più alta dell’idrogeno. In questo caso si deve considerare che l’idrogeno non può stare al centro della molecola, perché seguendo la regola del duetto, può formare al massimo 1 legame.
- Calcoliamo le coppie di elettroni impegnate nei legami. In questo caso N e C seguono la regola dell’ottetto, mentre H quella del duetto, quindi intorno a loro dovranno avere (2×8) + 2 = 18 elettroni per seguire la regola dell’ottetto. Pari a 9 coppie di elettroni. Il numero di legami è dato dalla differenza tra le coppie di elettroni totali dell’ottetto e quelle totali di valenza. Quindi abbiamo:

Dunque iniziamo a scrivere la prima bozza di struttura, mettendo 3 legami tra C e N e 1 tra C e H perché altrimenti l’idrogeno farebbe più di un legame violando la regola del duetto:
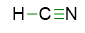
- Disponiamo le restanti coppie di elettroni come coppie di elettroni solitarie, di modo che ogni atomo segua la regola dell’ottetto. Siccome delle 5 coppie di valenza a disposizione, 4 sono state usate per i legami, resta 1 coppia da sistemare. Questa coppia andrà sull’azoto, che così raggiungerà l’ottetto, mentre il carbonio ha già 8 elettroni intorno a sé. La struttura diventa allora:

Questa è la struttura finale della molecola. Non occorre andare al punto 5, perché non ci sono strutture di risonanza di uguale bassa stabilità. Inoltre è inutile calcolare le cariche formali, perché non abbiamo dubbi con altre strutture.
Determinare la formula di struttura di SO42-
- Contiamo gli elettroni di valenza di tutti gli atomi e dividiamo per due.

- L’ atomo centrale è lo zolfo perché meno elettronegativo dell’ossigeno.
- Calcoliamo le coppie di elettroni impegnate nei legami. In questo caso S e O seguono entrambi la regola dell’ottetto, quindi intorno a loro dovranno avere 5×8 = 40 elettroni per seguire la regola dell’ottetto. Pari a 20 coppie di elettroni. Il numero di legami è dato dalla differenza tra le coppie di elettroni totali dell’ottetto e quelle totali di valenza. Quindi abbiamo:
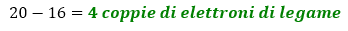
Dunque iniziamo a scrivere la prima bozza di struttura, mettendo 4 legami semplici tra S e O.
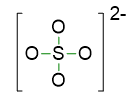
- Disponiamo le restanti coppie di elettroni come coppie di elettroni solitarie, di modo che ogni atomo segua la regola dell’ottetto. Siccome delle 16 coppie a disposizione, 4 sono state usate per i legami, restano 12 coppie da sistemare. Queste coppie andranno esclusivamente 3 su ciascun ossigeno, considerando che lo zolfo ha già rispettato la regola dell’ottetto. La struttura diventa allora:
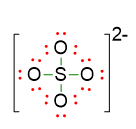
Non occorre andare al punto 5, perché non ci sono strutture di risonanza non essendoci doppi legami. Tuttavia siccome lo zolfo può estendere l’ottetto è bene verificare la stabilità della struttura ottenuta, tramite il calcolo delle cariche formali per ogni atomo.
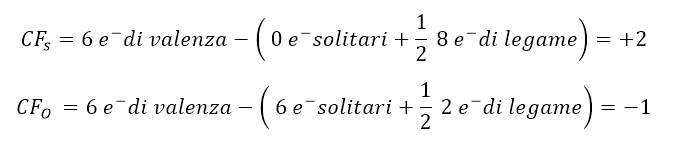
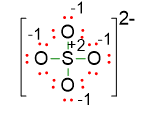
Come si vede lo zolfo ha carica +2, che è troppo alta per un non metallo. Dunque dobbiamo ritenere che la struttura ottenuta non sia stabile. Occorre cercarne un’altra considerando che lo zolfo possa espandere l’ottetto a 10 o anche a 12 elettroni.
Ripetiamo dunque il punto 3, mentre i punti 1 e 2 sono identici.
- Calcoliamo le coppie di elettroni impegnate nei legami. Consideriamo O come ottetto, e lo zolfo con ottetto espanso a 10 o 12 elettroni. Quindi nel caso in cui S abbia 10 elettroni intorno a sé, gli elettroni totali degli ottetti saranno (4×8)+10 = 42 elettroni. 42 elettroni sono pari a 21 coppie di elettroni. Il numero di legami è dato dalla differenza tra le coppie di elettroni totali dell’ottetto e quelle totali di valenza. Quindi abbiamo:
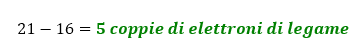
Dunque iniziamo a scrivere la prima bozza di struttura, mettendo 3 legami semplici tra S e O e 1 doppio.
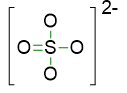
Nel caso, invece, in cui lo zolfo espandesse a 12 elettroni, le coppie di elettroni totali dell’ottetto sarebbero 22; di conseguenza le coppie di legame saranno date da:

Dunque scriviamo anche la seconda bozza di struttura, mettendo 2 legami semplici tra S e O e 2 doppi.
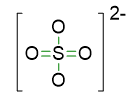
- Disponiamo le restanti coppie di elettroni come coppie di elettroni solitarie, di modo che ogni atomo segua la regola dell’ottetto. Per quanto riguarda la struttura con lo zolfo a 10 elettroni, delle 16 coppie di valenza a disposizione, 5 sono state usate per i legami, dunque ne restano 11 da sistemare. Queste coppie andranno 3 sui 3 atomi di ossigeno che formano un legame singolo S-O, e le restanti 2 coppie andranno sull’ossigeno che forma un doppio legame S-O. La struttura diventa allora:
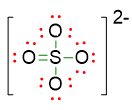
Per la struttura a 12 elettroni sullo zolfo, le coppie di elettroni solitarie da sistemare sono invece 10 e andranno 3 sui due atomi di O che formano il legame singolo e le restanti 4 coppie andranno sugli atomi di ossigeno coinvolti nel doppio legame. La struttura è allora:
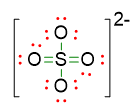
Calcolando, come fatto precedentemente, le cariche formali per queste due ultime strutture di Lewis otteniamo la seguente situazione:
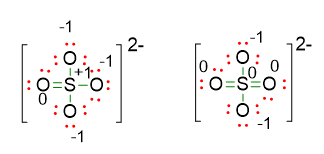
Si nota subito che la prima struttura ha uno zolfo con una carica positiva, mentre nella seconda struttura lo stesso atomo risulta neutro. Dunque la seconda struttura con lo zolfo a ottetto espanso a 12 elettroni è la più stabile.
- Essendoci doppi legami che si possono spostare nella molecola, è possibile scrivere delle strutture di risonanza. Quindi la struttura finale dello ione di solfato sarà:
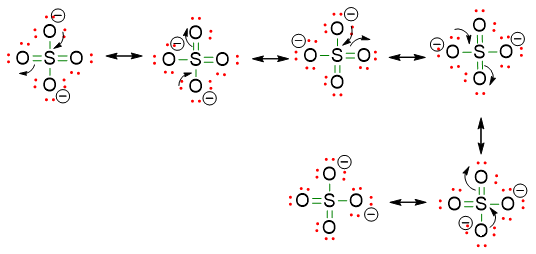
Determinare la formula di struttura di NCO–
- Contiamo gli elettroni di valenza di tutti gli atomi e dividiamo per due.

- L’ atomo centrale è il carbonio perché è il meno elettronegativo rispetto agli atri due..
- Calcoliamo le coppie di elettroni impegnate nei legami. In questo caso tutti e 3 gli atomi seguono la regola dell’ottetto, quindi intorno a loro dovranno avere 3×8 = 24 elettroni per seguire la regola dell’ottetto. 24 elettroni sono pari a 12 coppie di elettroni. Il numero di legami è dato dalla differenza tra le coppie di elettroni totali dell’ottetto e quelle totali di valenza. Quindi abbiamo:

Dunque iniziamo a scrivere la prima bozza di struttura, mettendo 2 legami tra C e N e 2 tra C e O. Potremmo anche provare a mettere 3 legami tra C e N e 1 tra C e O, o ancora 3 legami tra C e O e uno tra C e N. In tutto avremo tre possibili bozze di struttura.

- Disponiamo le restanti coppie di elettroni come coppie di elettroni solitarie, di modo che ogni atomo segua la regola dell’ottetto. Restano da sistemare 4 coppie di elettroni. Il carbonio centrale ha già soddisfatto la regola dell’ottetto in tutte e 3 le strutture, restano da sistemare solo le coppie solitarie per N e O. Le 3 possibili strutture diventano allora:
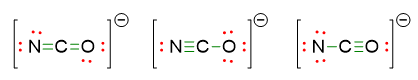
- Le strutture di risonanza sono quelle che abbiamo in realtà già scritto nelle 3 possibili strutture di sopra. Infatti tutte e 3 le strutture differiscono per la posizione di un legame multiplo.
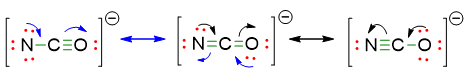
- Quindi la reale formula di Lewis è una combinazione di tutte e tre. Tuttavia possiamo fare il calcolo delle cariche formali per vedere quale delle 3 strutture di risonanza è più stabile. Si ottengono le seguenti cariche:
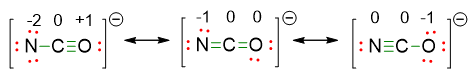
Dai risultati ottenuti si vede che la prima formula di risonanza è certamente la meno stabile perché una carica positiva finisce su un atomo elettronegativo come l’ossigeno. La seconda e la terza struttura sono certamente quelle favorite, con l’ultima leggermente più stabile perché la carica negativa va sull’ossigeno che è più elettronegativo dell’azoto.

Hai bisogno di più esercizi svolti ? Puoi trovarne altri 5 nel pdf o nel file docx che puoi scaricare qui.
Questa lezione

Strutture Lewis-Esercizi
€
1.50
Trovi altri 5 esercizi svolti
Scarica pdf (non modificabile)

Strutture Lewis-Esercizi
€
2.20
Trovi altri 5 esercizi svolti
Scarica docx (modificabile)



3 risposte su “Le strutture di Lewis-Esercizi”
Grazie per gli esercizi, davvero utili.
Grazie mi hai salvato il compito 🙂
Meno male, Ciro! Buona giornata