Le strutture di Lewis si definiscono come:
Modalità di rappresentare gli atomi, gli ioni o le molecole usando la regola dell’ottetto.
Si usano punti per indicare gli elettroni di valenza degli atomi (vedi Figura 1). Due punti (o in alternativa un trattino) possono indicare una coppia solitaria o se condivisi tra due atomi indicano una coppia di legame. Un elettrone isolato indica un elettrone spaiato.

Simboli di Lewis per gli atomi
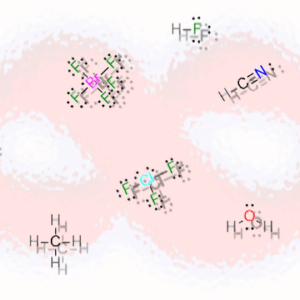
Iniziamo con gli atomi singoli. In questo caso la struttura di Lewis consiste semplicemente nel simbolo dell’elemento assieme agli elettroni di valenza intorno all’elemento stesso.
Gli elettroni di valenza per ogni elemento sono facilmente ottenibili dalla Tavola Periodica vedendo il gruppo di appartenenza dell’elemento. In particolare gli elettroni di valenza coincidono con il numero del gruppo per i primi due gruppi:
– Gruppo 1 (o IA): gli elettroni di valenza sono 1
– Gruppo 2 (o IIA): gli elettroni di valenza sono 2
Mentre gli elettroni di valenza per i gruppi da 13 a 18 si ricavano sottraendo 10 dal numero del gruppo. Ad esempio:
– Gruppo 13 (o III A): gli elettroni di valenza sono 13 – 10 = 3
– Gruppo 14 (o IV A): gli elettroni di valenza sono 14 – 10 = 4
– E così via fino al diciottesimo gruppo che avrà 8 elettroni di valenza.
I simboli di Lewis per gli elementi dei gruppi principali hanno sempre gli stessi elettroni di valenza per gli elementi appartenenti allo stesso gruppo e rispecchiano la configurazione elettronica più esterna dell’elemento.
Per esempio il simbolo di Lewis dell’idrogeno è costituito dalla lettera H con un singolo elettrone spaiato (vedi Figura 2); questo perché l’idrogeno ha un unico elettrone nel suo orbitale 1s. Tuttavia lo stesso elettrone spaiato sarà posseduto da tutti gli altri elementi dello stesso gruppo 1. Questo perché, come già detto, i simboli di Lewis riportano solo gli elettroni di valenza, mentre gli elettroni più interni non vengono considerati. Quindi il Litio pur avendo 3 elettroni in tutto, verrà comunque indicato con un elettrone spaiato perché i due elettroni interni nell’orbitale 1s non sono elettroni di valenza, mentre l’elettrone di valenza è nell’orbitale più esterno 2s. Il sodio avrà il suo elettrone di valenza nel 3s e così via.
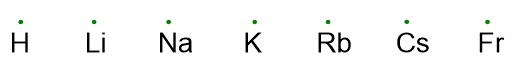
Nella tabella che segue (Tabella 1) si riassumono i simboli di Lewis per i gruppi degli elementi principali.

Quindi se voglio scrivere il simbolo di Lewis per l’ossigeno basterà vedere la colonna del gruppo 16 nella tabella sovrastante e sostituire X con O, il risultato sarà:

Gli stessi elettroni li metteremo per gli elementi dello stesso gruppo, quindi S, Se, Te, Po.
La presenza di elettroni spaiati o come coppia solitaria dipende dalla distribuzione degli elettroni negli orbitali di valenza. Per esempio la configurazione del gruppo 16 prevede due coppie di elettroni solitarie e due elettroni spaiati, questo perché la configurazione degli elettroni in tale gruppo è ns2+np4 che si dispongono negli orbitali nel seguente modo:
Per capire come mai gli elettroni si dispongono così bisognerà studiare la configurazione elettronica degli elettroni, un concetto un po’ più avanzato che prevede la conoscenza degli orbitali atomici. Per il momento basti considerare la tabella riassuntiva (Tabella 1) per sapere come scrivere i simboli di Lewis per gli elementi dei gruppi principali.
Il modello di Lewis per i metalli di transizione, i lantanidi e gli attinidi non viene adoperato perché tali elementi hanno elettroni di valenza anche negli orbitali d (metalli di transizione) e f (attinidi e lantanidi) e questo ne determina un differente comportamento che può essere spiegato solo con metodi più avanzati che tengano conto degli orbitali atomici.

Vuoi sapere un trucco per calcolare le cariche formali senza ricordarsi la formula? Lo trovi a pagina 6 del pdf o del file docx che puoi scaricare qui.
Strutture di Lewis per le molecole
La regola dell’Ottetto
Le strutture di Lewis per scrivere le molecole si basano sulla regola dell’ottetto. La regola dell’ottetto sostiene che
un atomo tende a reagire con altri atomi formando legami al fine di raggiungere un numero di elettroni esterni pari a 8.
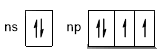
Questo numero di elettroni dà stabilità all’atomo ed equivale al numero di elettroni di valenza posseduti dai gas nobili (Gruppo 18 della Tavola Periodica degli elementi). Tali elementi infatti tendono generalmente a non reagire e a restare atomi singoli. Nella Figura 4 si vede l’atomo di neon con i suoi elettroni di valenza pari a 8. In particolare l’atomo di neon ha 8 elettroni nel livello energetico n=2, mentre ha 2 elettroni nel livello n=1. Questi ultimi 2 elettroni sono nel guscio interno dell’atomo, quindi non vengono considerati nel modello di Lewis.
Ci sono tuttavia delle eccezioni alla regola dell’ottetto. A fare eccezione sono:
- L’idrogeno (H) e l’elio (He) ai quali bastano 2 elettroni per raggiungere la stabilità.
- Alcuni elementi dal 3° periodo in poi della tavola periodica che possono presentare ottetto espanso, ossia avere intorno a sé non 8 elettroni in totale, ma da 10 a 12 elettroni. Questa eccezione vale nella maggior parte dei casi per elementi come zolfo (S) e fosforo (P) e in misura minore per altri elementi come Cl, Br, Xe etc.
- Altri elementi possono avere ottetto incompleto. È il caso degli elementi quali boro (B) e alluminio (Al) ai quali 6 elettroni sono sufficienti per la loro stabilità. O anche il Berillio (Be) a cui bastano 4 elettroni.
- I metalli di transizione, i lantanidi e gli attinidi per i quali, come già detto, servono modelli più avanzati per descriverne la geometria e reattività.
Le 4+2 Regole per scrivere le Strutture di Lewis
Vediamo ora come rappresentare nella pratica le strutture di Lewis.
Le seguenti regole, da seguire in ordine numerico, possono esserti di aiuto:
- Contare gli elettroni di valenza di tutti gli atomi della molecola e sommarli. Considerare nel conteggio anche le eventuali cariche negative presenti. Poi dividere per due la somma in modo da trovare le coppie di elettroni da sistemare.
Esempio) prendiamo lo ione NO3– e contiamo gli elettroni di valenza. L’N ha 5 elettroni di valenza, l’O ne ha 6, ma, siccome ci sono 3 atomi nella molecola, in tutto l’ossigeno contribuisce con 6×3= 18 elettroni. Inoltre c’è una carica negativa. Quindi se sommiamo tutto abbiamo 24 elettroni.

Dividiamo tale somma per due per ottenere le coppie di elettroni da sistemare intorno agli atomi.

Nota: sono queste coppie di elettroni di valenza che andranno tutte sistemate come coppie di legame o coppie solitarie sugli atomi, al fine di ottenere la struttura di Lewis finale. Quindi tenete il conteggio delle coppie di valenza da parte, perché ci servirà in continuazione.
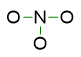
- Posizionare al centro l’atomo con elettronegatività inferiore perché è quello che più facilmente condividerà buona parte dei suoi elettroni con altri atomi. Collegare questo atomo tramite dei legami semplici agli altri atomi intorno, così da iniziare a costruire la struttura della molecola.
Nel nostro esempio è l’atomo di azoto ad avere elettronegatività inferiore (3,04 di N contro 3.44 di O), quindi lo posizioniamo al centro con gli atomi di ossigeno intorno, legati all’azoto tramite una coppia di elettroni, indicata dal trattino. Abbiamo così già sistemato 3 delle 12 coppie di elettroni di valenza, ne restano 9 da inserire nella struttura di Lewis.
- Calcolare le coppie di elettroni impegnate nei legami. A tal fine, si calcola la somma degli elettroni totali che ogni atomo deve avere intorno per essere stabile seguendo la regola dell’ottetto. Quindi 8 elettroni per tutti gli elementi principali, escluso H e He a cui invece bastano 2 elettroni. Inoltre, occorre considerare che elementi come S o P potrebbero espandere l’ottetto fino a 10, 12 elettroni. In ultima analisi, considerare che B e Al potrebbero avere ottetto incompleto, quindi potrebbero essere sufficienti solo 6 elettroni per essere stabili. Tale somma degli ottetti, duetti, ottetti espansi o incompleti va sottratta alla somma degli elettroni di valenza calcolati al punto [1]. La differenza va divisa per due per ottenere le coppie di elettroni di legame.
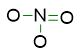
Tornando al nostro esempio, ad N servono 8 elettroni per essere stabile e così anche ai 3 ossigeni, quindi la somma degli elettroni degli ottetti è data da 4×8= 32 elettroni, che diviso 2 danno 16 coppie di elettroni. La differenza tra queste coppie e quelle di valenza (12), ci dà gli elettroni che partecipano ai legami chimici.

Siccome le coppie di elettroni che partecipano ai legami sono 4 e noi ne avevamo precedentemente sistemate 3 nel primo prototipo della nostra formula di struttura, significa che dobbiamo sistemare ancora una coppia di elettroni che partecipano ai legami. In particolare, dobbiamo inserire un doppio legame tra un N-O. Quindi la struttura diventa ora:
- Disporre le restanti coppie di elettroni di valenza come coppie di elettroni solitarie in modo che ogni singolo atomo della molecola rispetti la regola dell’ottetto (o sue eccezioni, ad es. regola del duetto per H e He).
Per la molecola di NO3–, delle 12 coppie di valenza da sistemare, ne abbiamo già impiegate 4 per i legami, quindi ne restano 8. Come si vede in figura, N ha già raggiunto l’ottetto con gli elettroni di legame.
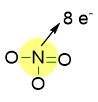
Quindi dobbiamo sistemare le coppie di elettroni solitarie solo sugli atomi di ossigeno, facendo in modo che ogni ossigeno raggiunga 8 elettroni intorno a sé, come descritto dalla figura in basso.
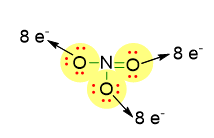
Abbiamo disposto quindi 3 coppie di elettroni solitarie (indicate in rosso) sugli ossigeni che formano un solo legame con N e 2 coppie di elettroni solitarie con l’ossigeno che forma il doppio legame con N. Considerando la carica negativa che c’è nella formula molecolare, possiamo scrivere la struttura di Lewis completa, come segue:
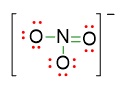
- Vedere se ci sono delle possibili strutture di risonanza. In alcune strutture di Lewis è possibile collocare i legami multipli in più posizioni equivalenti. Le strutture differiscono solo per la posizione del doppio legame.
Tornando proprio all’esempio della molecola di NO3–, è possibile spostare il doppio legame coinvolgendo un atomo di ossigeno differente. Si ottengono in questo modo altre 2 strutture, la 2 e la 3, esattamente equivalenti a quella originaria, 1.
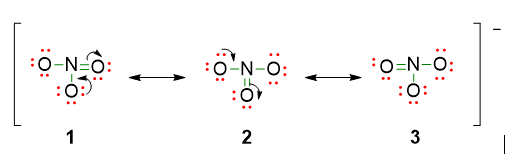
Le strutture di risonanza sono tutte valide e caratterizzate dalla stessa energia. Nessuna è giusta, nessuna lo è da sola. Le prove sperimentali di tali strutture dicono che la lunghezza dei legami è identica ed è intermedia tra la lunghezza del doppio legame e quella del legame singolo.
Si chiama RISONANZA questa combinazione di strutture nelle quali gli atomi sono ugualmente collocati, mentre la disposizione degli elettroni è differente. Gli elettroni interessati nelle strutture di risonanza si dicono delocalizzati perché la densità elettronica degli elettroni del doppio legame, non è più localizzata solo tra due atomi, ma si distribuisce su più atomi della stessa molecola.
Vediamo ora l’ultima regola per scrivere le strutture di Lewis.
- In alcuni casi si potrebbe essere incerti tra più strutture di Lewis possibili, in tal caso è bene aiutarsi nella valutazione della struttura esatta attraverso il calcolo della carica formale. La carica formale fornisce un’indicazione della misura con la quale gli atomi hanno acquistato o ceduto carica elettronica nel processo di formazione dei legami. Strutture con le cariche formali più basse, sono quelle che hanno maggiore probabilità di essere stabili.
La carica formale (CF) si calcola per ciascun atomo all’interno della struttura di Lewis nel seguente modo:
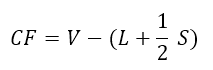
Dove:
- V sono gli elettroni di valenza dell’atomo in analisi;
- L sono gli elettroni solitari presenti sull’atomo;
- S sono gli elettroni condivisi, quindi quelli di legame.
Le strutture di Lewis possiedono la minima energia quando le cariche formali dei singoli atomi non metallici sono più vicine a zero.
In una molecola neutra la somma delle cariche formali deve essere uguale a zero, in uno ione deve dare la carica dello ione.
Tornando alla molecola di NO3–, il calcolo delle cariche formali per la nostra struttura di Lewis sarebbe:

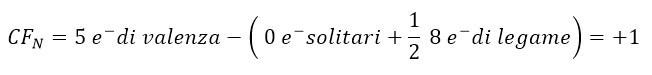
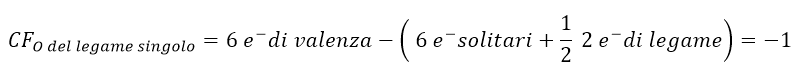
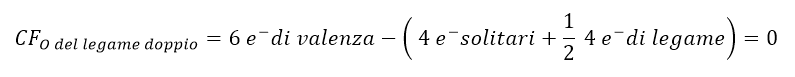
Tali cariche formali possono essere scritte nella struttura di Lewis come segue:
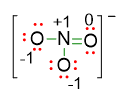
È da notare però che una volta calcolata la carica formale per ogni atomo, la carica totale deve corrispondere a quella della formula molecolare.
Nel nostro esempio, la struttura finale sarà dunque con carica totale 1-, perché se sommiamo le 4 cariche formali presenti sugli atomi, il risultato è 1- (da (+1 di N) + 2 (-1 di O) + (0 di O) = -1). Tale carica coincide con quella data dalla formula molecolare NO3–.
Allo scopo di capire meglio l’utilità del calcolo delle cariche formali, prendiamo come esempio la molecola di SO42- . In questo caso potremmo essere incerti su tre possibili strutture di Lewis, perché non sappiamo se lo zolfo ha ottetto completo o ottetto espanso a 10 o ancora a 12 elettroni.
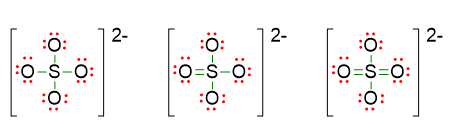
Se scriviamo le cariche formali su ogni atomo di queste tre strutture otterremo la seguente situazione:
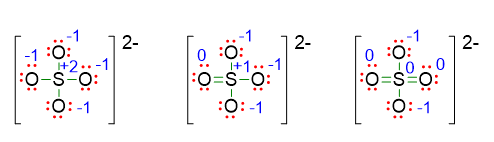
Nella prima struttura lo zolfo ha carica formale +2, questa carica è abbastanza alta per un non metallo, quindi potremmo dedurre che la prima struttura non sia molto stabile. Nella seconda lo zolfo assume carica +1, che è più bassa della precedente, ma è sempre una carica positiva su un non-metallo. Dunque l’ultima struttura di Lewis è certamente la più stabile perché lo zolfo ha carica pari a 0. Questa ultima struttura è infatti quella corretta.
Questa lezione

Strutture di Lewis-pdf
€
1.00
Scarica pdf (non modificabile)

Strutture di Lewis-docx
€
2.00
Scarica docx (modificabile)