Introduzione
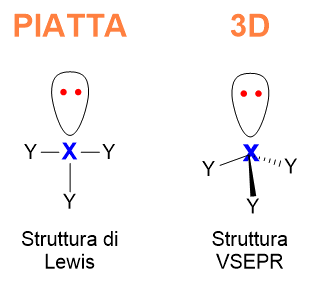
Con tale modello ci sposteremo dal mondo piatto e noioso delle strutture di Lewis al mondo ampio e geometrico del 3D (Figura 1).
Una volta imparato a disporre i legami e doppietti solitari grazie ai ragionamenti di Lewis, lo studente curioso potrebbe chiedersi: << Qual è la struttura 3D delle molecole? Le molecole sono piatte come le vede Lewis, o hanno una forma 3D? >>
A questa domanda troverete risposta in questo articolo. Ma iniziamo dall’inizio, cosa vuol dire VSEPR?
VSEPR sta per valence shell electron pairs repulsion.
Dalle prime due parole in blu apprendiamo il primo concetto importante di tale modello: il VSEPR si concentra sugli elettroni di valenza dell’atomo centrale della molecola (anche se atomo centrale è sottointeso nell’acronimo). Le restanti parole in viola ci dicono che il modello si basa sulle repulsioni delle coppie di elettroni intorno all’atomo centrale al fine di ottenere la struttura tridimensionale della molecola.
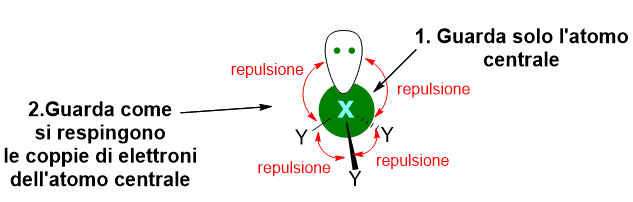
In altre parole tale modello determina la struttura 3D della molecola guardando alle coppie di elettroni di valenza del solo atomo centrale della molecola e assumendo che tali coppie, essendo tutte cariche negativamente, tenderanno a respingersi tra di loro e quindi a sistemarsi spazialmente il più lontano possibile l’una coppia dall’altra (Figura 2).

Vuoi avere il nostro diagramma di flusso che riassume le regole da 1-6 in un semplice foglio da portare con te? Lo trovi a pagina 6 del pdf o del file docx relativo a tutto questo articolo che puoi scaricare qui.
Disposizione spaziale degli elettroni
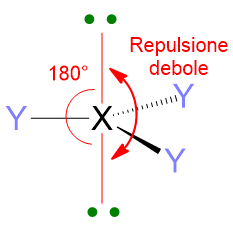
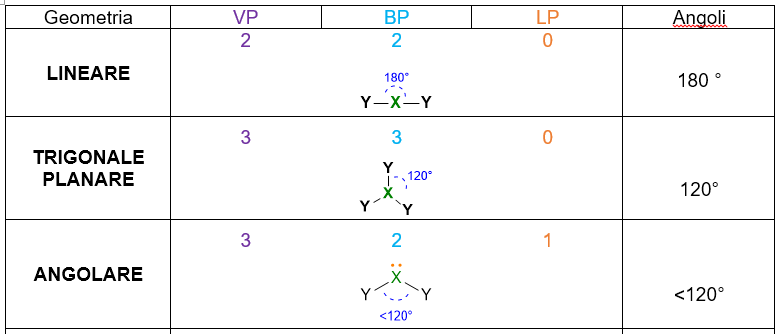
Dunque è la repulsione delle coppie di elettroni a determinare la forma della molecola. Facciamo un esempio, se abbiamo due coppie di elettroni intorno all’atomo centrale, non importa al momento se sono coppie di legame o solitarie, tali coppie si disporranno in modo da stare il più lontano possibile spazialmente, quindi formando un angolo di 180° l’una dall’altra (Figura 3). Di conseguenza, la disposizione spaziale di tali coppie sarà dunque lineare.
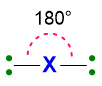
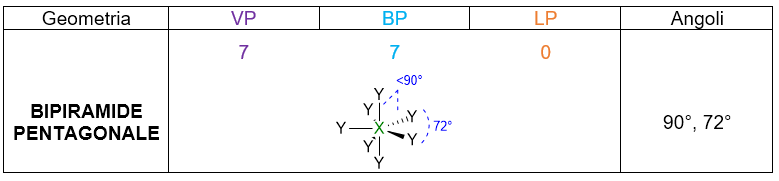
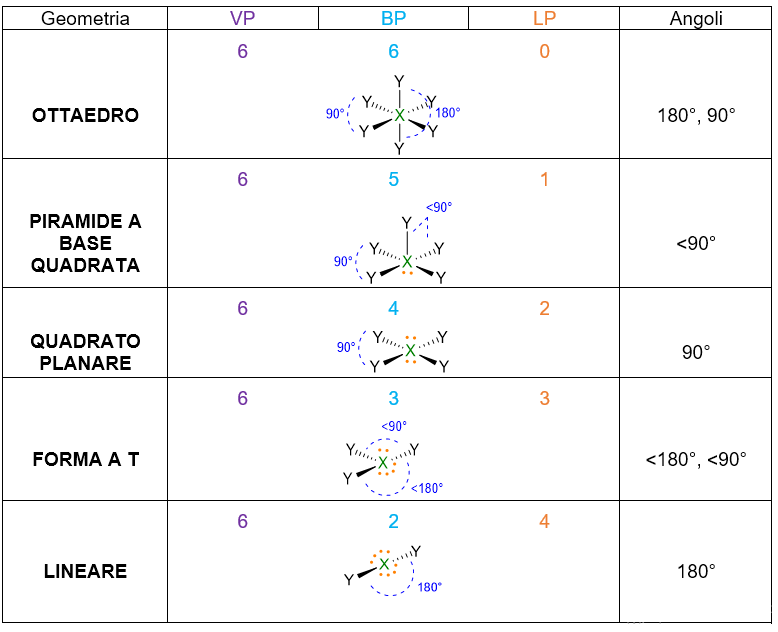
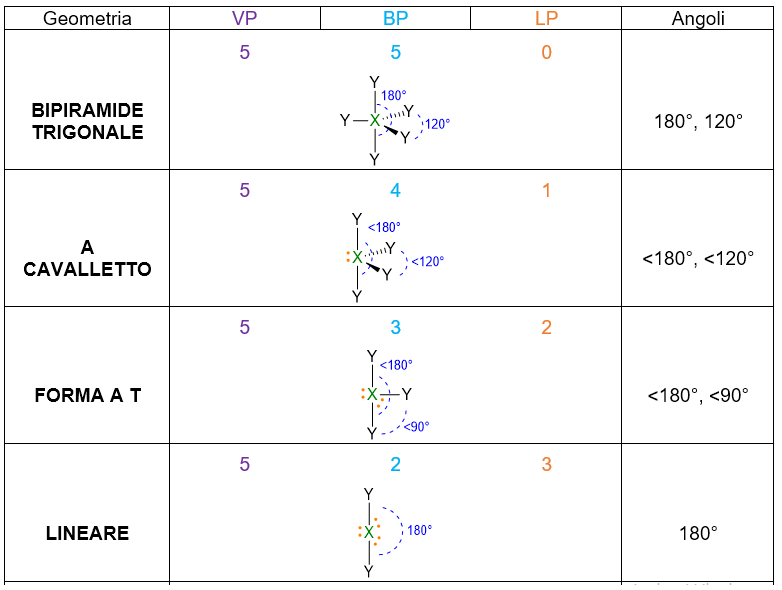
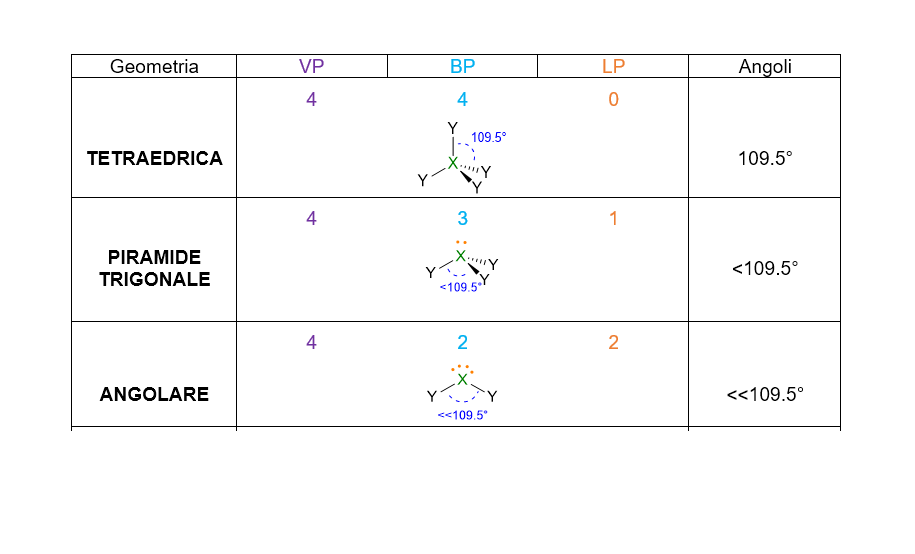
A seconda del numero di coppie di elettroni che abbiamo intorno all’atomo centrale, ci saranno varie disposizioni spaziali. La tabella che segue (Tabella 1), le riassume tutte, da 2 coppie fino a 7 coppie. Per esempio 3 coppie di elettroni intorno all’atomo centrale si disporranno a 120° l’una dall’altra in modo da formare una trigonale planare. 4 coppie invece, si sistemeranno a 109.5° di distanza dando vita al tetraedro. E così via per le coppie da 5 a 6, che assumeranno disposizione rispettivamente di bipiramide trigonale e ottaedro. Per 7 coppie di elettroni più disposizioni sono possibili.

Coppie di legame e coppie solitarie
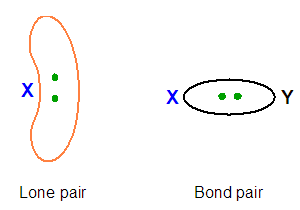
Finora abbiamo considerato le coppie di elettroni come generiche, nella realtà, però, tali coppie possono essere coppie solitarie (anche dette lone pairs) o coppie di legame (anche dette bond pairs) (Figura 4).
Nel modello VSEPR, si assume che le coppie solitarie richiedano più spazio delle coppie di legame. La ragione di questo risiede nel fatto che le coppie solitarie risentono della carica nucleare effettiva di un solo atomo, mentre le coppie di legame risentono della carica nucleare effettiva di due atomi.
Tale differenza tra coppie solitarie e coppie di legame si vede anche nella diversa densità elettronica intorno all’atomo centrale. In particolare, le coppie solitarie contribuiscono con due cariche negative nette intorno all’atomo centrale, mentre le coppie di legame, avendo i due elettroni condivisi tra due nuclei, forniscono una densità elettronica inferiore a due elettroni. Questo comporta il seguente ordine di repulsione tra le coppie di elettroni:

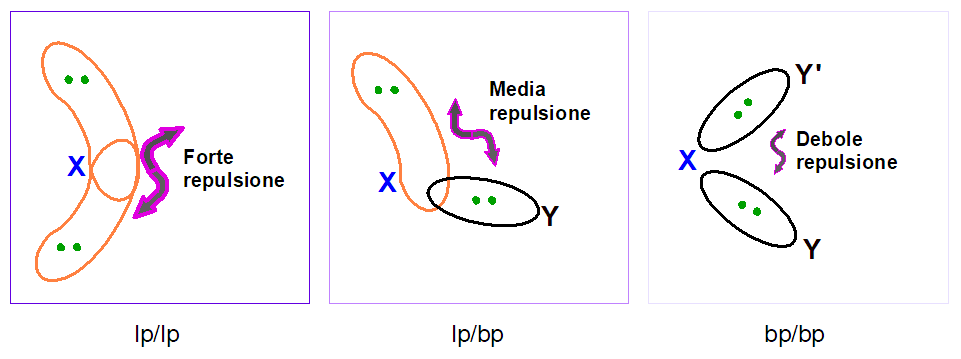
Dunque due coppie solitarie (lp/lp) si respingono con forza maggiore rispetto a una coppia solitaria e una di legame (lp/bp). La repulsione più debole è tra due coppie di legame (bp/bp).
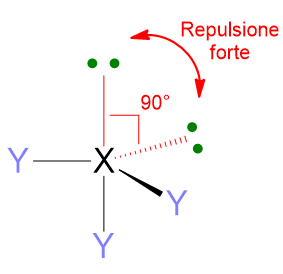
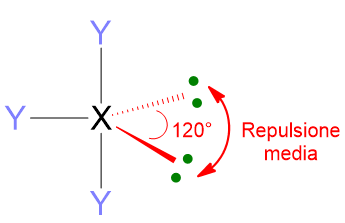
Un altro aspetto importante di queste repulsioni è che esse dipendono dalla distanza angolare a cui si trovano le coppie di elettroni. 2 coppie di elettroni che si trovano a 90° l’una dall’altra si respingeranno molto di più che due coppie a 120° o ancora di più di quelle a 180°. Dunque le repulsioni a 90° sono quelle più importanti per definire la geometria molecolare.
Disposizione spaziale vs geometria molecolare
Prima di andare avanti è importante distinguere tra il termine disposizione spaziale degli elettroni e geometria molecolare:
- La disposizione spaziale degli elettroni indica la posizione degli elettroni intorno all’atomo centrale; questa non può essere determinata sperimentalmente.
- La geometria molecolare indica la posizione spaziale dei nuclei della molecola; essa può essere determinata sperimentalmente.
Un esempio per cosa si intende per disposizione spaziale degli elettroni lo abbiamo visto nella tabella precedente (Tabella 1). Mentre il concetto di geometria molecolare lo andremo a imparare di seguito.
Come determinare la geometria molecolare
Dopo queste premesse, come ricavare la geometria di una molecola con il VSEPR?
Basta seguire le seguenti indicazioni.
- Scrivi la struttura di Lewis della molecola.
- Conta le coppie di legame e solitarie dell’atomo centrale che ci sono nella struttura di Lewis. Puoi aiutarti con la seguente equazione:
VP = BP + LP
Dove VP = valence pairs (coppie di elettroni di valenza)
BP = bond pairs (coppie di elettroni di legame)
LP = lone pairs (coppie di elettroni solitarie)
- A seconda del numero di VP considera la disposizione spaziale degli elettroni che ti ho fornito in Tabella 1. Es. VP = 4, la disposizione spaziale degli elettroni è tetraedrica, con angoli di 109.5°.
- Se la molecola ha LP = 0, allora la disposizione spaziale della molecola equivale alla geometria molecolare. In tal caso hai già individuato la geometria e quindi hai concluso.
- Se la molecola ha LP = 1, ma VP < 5, allora la geometria della molecola è facilmente determinabile dalla disposizione spaziale data in Tabella 1 a cui però bisogna cancellare il lone pair (LP) (Vedi esempio sotto). Se la molecola ha LP = 1, ma VP ≥ 5, allora bisogna di nuovo partire dalla disposizione spaziale data in Tabella 1, ma occorre questa volta, prima stabilire la posizione di LP, se andrà in assiale o in equatoriale. Per decidere la posizione più stabile di LP, ti basterà vedere la struttura che minimizza le repulsioni lp/bp. Una volta stabilità la struttura più stabile, cancella il lone pair per ottenere la geometria molecolare. (Vedi esempio sotto).
N.B.: Le coppie di elettroni solitarie non devono mai essere considerate nella geometria molecolare, dato che la geometria è sempre e solo definita dalla posizione dei nuclei della molecola; quindi nel definire la geometria molecolare, ricorda di cancellare i lone pairs e considerare solo i bond pairs.
Facciamo un primo esempio per capire i punti 1-5. La molecola di NH3 ha la seguente struttura di Lewis (punto 1), da cui possiamo calcolare VP, BP e LP (punto 2).
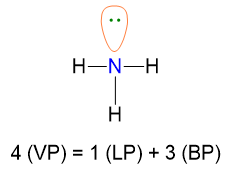
VP = 4 quindi la disposizione spaziale è tetraedrica (punto 3).
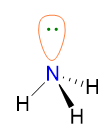
Tuttavia l’ammoniaca ha LP = 1 (punto 5) quindi la sua geometria sarà determinata dai 3 BP rimanenti, ossia occorre cancellare il lone pair; perciò la geometria di NH3 è piramidale.
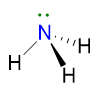
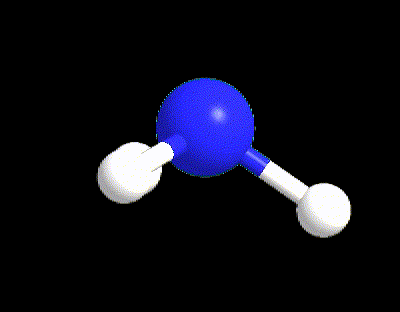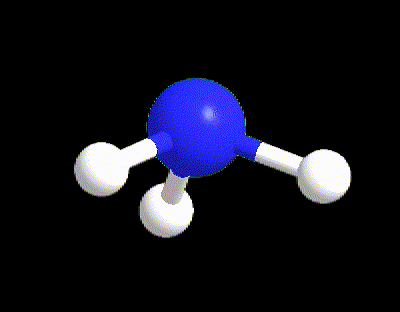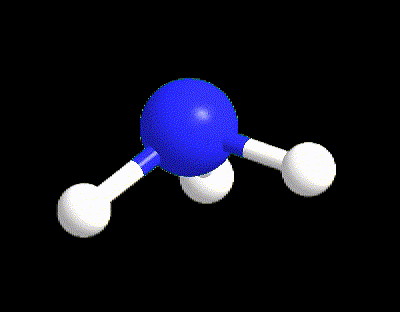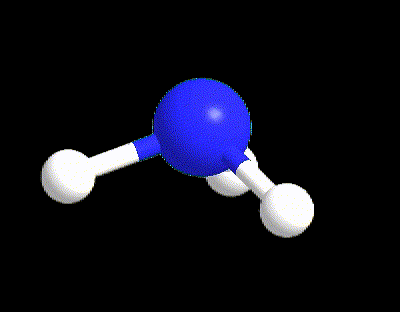
Facciamo un altro esempio per capire il punto 5 per il caso VP ≥ 5, prendendo la molecola di SF5. La sua struttura di Lewis è la seguente:
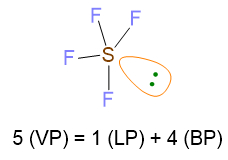
VP = 5 quindi la disposizione spaziale è bipiramide trigonale. Tuttavia siccome LP =1 con VP ≥ 5, si configura il problema di dove disporre la coppia solitaria, se nella posizione equatoriale o assiale della bipiramide trigonale. Vanno perciò valutate tutte le possibilità e va poi scelta la disposizione che minimizza le repulsioni lp/bp a 90°. Dalla figura di sotto si evince, che la posizione del lone pair in assiale dà origine a 3 repulsioni lp/bp a 90°, mentre se il lone pair è equatoriale, le repulsioni lp/bp a 90° si riducono a 2, anche se ci sarebbero anche 2 repulsioni a 120°, ma queste sono di minore entità perché l’angolo è maggiore. Dunque la disposizione più stabile è la seconda.
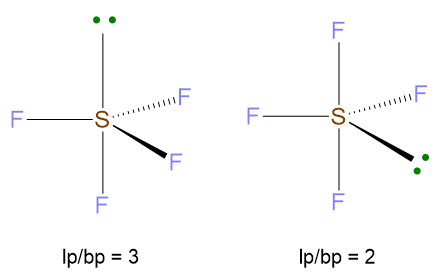
La geometria sarà determinata dai 4 BP meno LP, ossia occorre cancellare LP dalla struttura. La geometria che ne deriva è la forma a cavalletto.
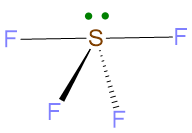
Vediamo ora l’ultimo caso e quindi anche l’ultima regola.
- Se la molecola ha LP ≥ 2, ma VP < 5 allora la geometria è determinata dalla posizione dei soli BP (ossia cancellando LP). Se la molecola ha LP ≥ 2 e VP ≥ 5, posiziona i lone pairs in modo da minimizzare le repulsioni lp/lp e bp/lp a 90°, dando priorità alle repulsioni lp/lp dato che sono le più forti. Infine, determina la geometria dalla posizione consequenziale delle coppie di legame, BP.
Vediamo due esempi per capire il punto 6.
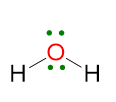
Un esempio per il caso LP ≥ 2, ma VP < 5 è la molecola di acqua. La struttura di Lewis è la seguente:
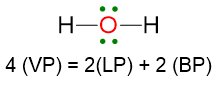
VP = 4, quindi la disposizione spaziale degli elettroni è tetraedrica.
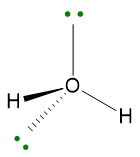
La geometria sarà però angolare perché i due lone pairs non vengono considerati.
Un esempio per il caso LP ≥ 2, ma VP ≥ 5 è la molecola di ClF3, per la quale la struttura di Lewis e il conteggio delle coppie di elettroni sono le seguenti:
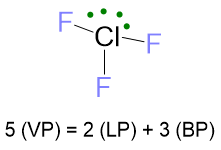
La disposizione degli elettroni per VP = 5 è la bipiramide trigonale. Il problema che si crea è nella posizione dei due lone pairs. Infatti ci sono tre possibilità:
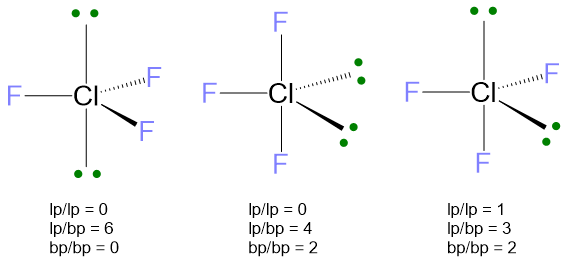
Nella prima struttura i lone pairs sono in assiale, distanti 180°, nella seconda sono in equatoriale a 120° e nell’ultima sono uno in assiale e uno in equatoriale con angolo di 90° l’uno dall’altro. Valutando le repulsioni a 90°, si vede che le repulsioni lp/lp a 90° sono assenti nelle prime due strutture, mentre c’è repulsione lp/lp per l’ultima struttura, che quindi può essere già esclusa perché le repulsioni lp/lp sono quelle che più destabilizzano la geometria. Tra la prima e la seconda struttura, la più stabile è la seconda perché ha solo 4 repulsioni lp/bp, mentre la prima ne ha ben 6. Le repulsioni bp/bp anche se presenti nella seconda e non nella prima, sono di inferiore entità; quindi le 2 repulsioni bp/bp della seconda struttura non sono così destabilizzanti come le 2 lp/bp in più possedute dalla prima struttura.
La geometria molecolare si ricava dalla seconda struttura, cancellando i due LP. Si ottiene dunque la forma a T.
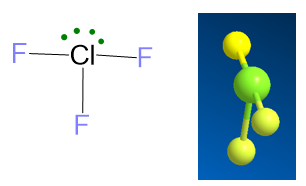
Tabella riassuntiva
La tabella che segue (Tabella 2, scorri per vederla tutta) può essere un valido aiuto per svolgere la maggior parte degli esercizi sul VSEPR perchè riassume tutta la casistica delle molecole dei gruppi principali.
Angoli di legame nel VSEPR
Come potresti notare dalla tabella, le molecole con almeno un LP hanno angoli inferiori rispetto agli angoli delle molecole con la stessa diposizione spaziale (stesso VP) ma senza LP.
Per esempio, gli angoli della piramide trigonale (VP = 4) sono inferiori di 109.5° che sono gli angoli della geometria tetraedrica (VP = 4, LP = 0). Questo accade perché se è presente un LP nella molecola, tale LP essendo più repulsivo e occupando più spazio, rimpicciolisce gli angoli tra le coppie di legame.
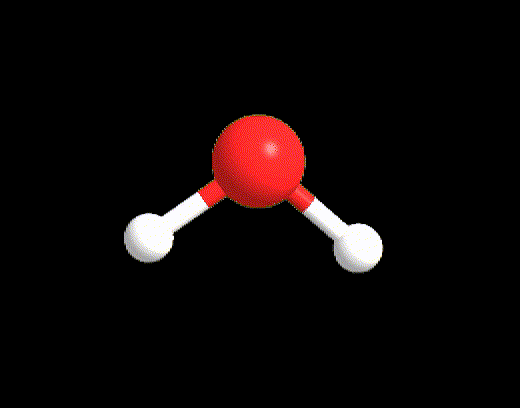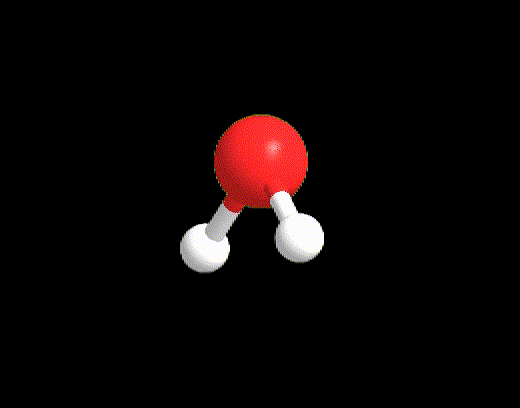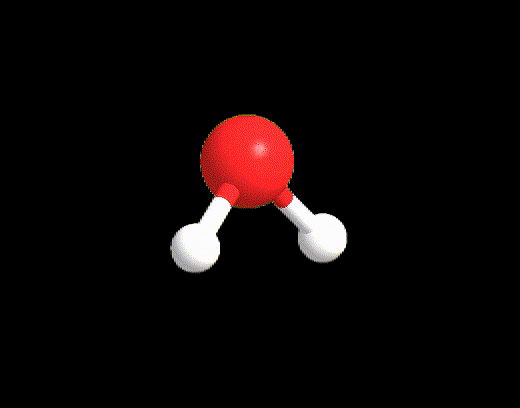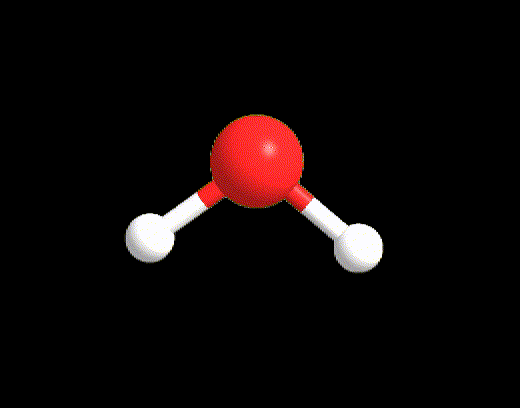
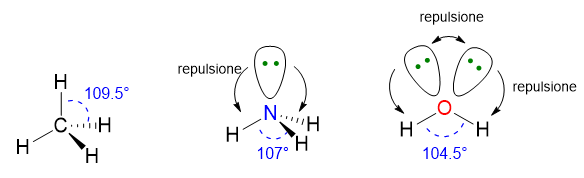
Dei tipici esempi sono le molecole di CH4, NH3 e H2O. Tutte e tre le molecole hanno VP = 4, quindi hanno la stessa disposizione spaziale degli elettroni che è tetraedrica. Tuttavia solo CH4 (LP = 0) possiede i perfetti angoli di 109.5° del tetraedro, mentre NH3 e H2O hanno angoli di 107° e 105° rispettivamente (Figura 6). Gli angoli dell’acqua sono anche più ridotti perché ci sono 2 LP nella molecola che esercitando una repulsione maggiore sia tra di loro sia verso i BP, restringono ancora di più l’angolo tra le due coppie di legame.
Questa lezione

VSEPR
€
1.50
Trovi anche il diagramma di flusso
Scarica pdf (non modificabile)

VSEPR
€
2.20
Trovi anche il diagramma di flusso
Scarica docx (modificabile)


Una risposta su “VSEPR”
Veramente originale e molto utile. Finalmente ho capito l’argomento.