Introduzione
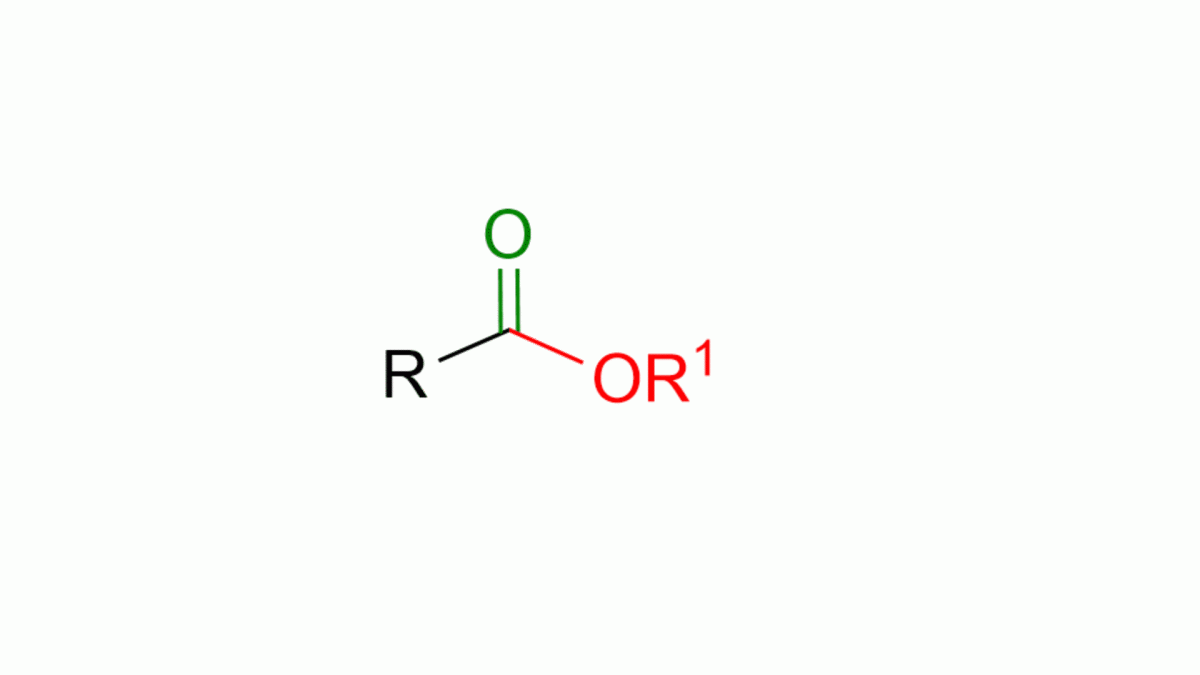
In questo articolo vediamo le reazioni più comuni per formare gli esteri. Se non ti ricordi cos’è un estere, puoi vederne la struttura nella figura animata in basso.
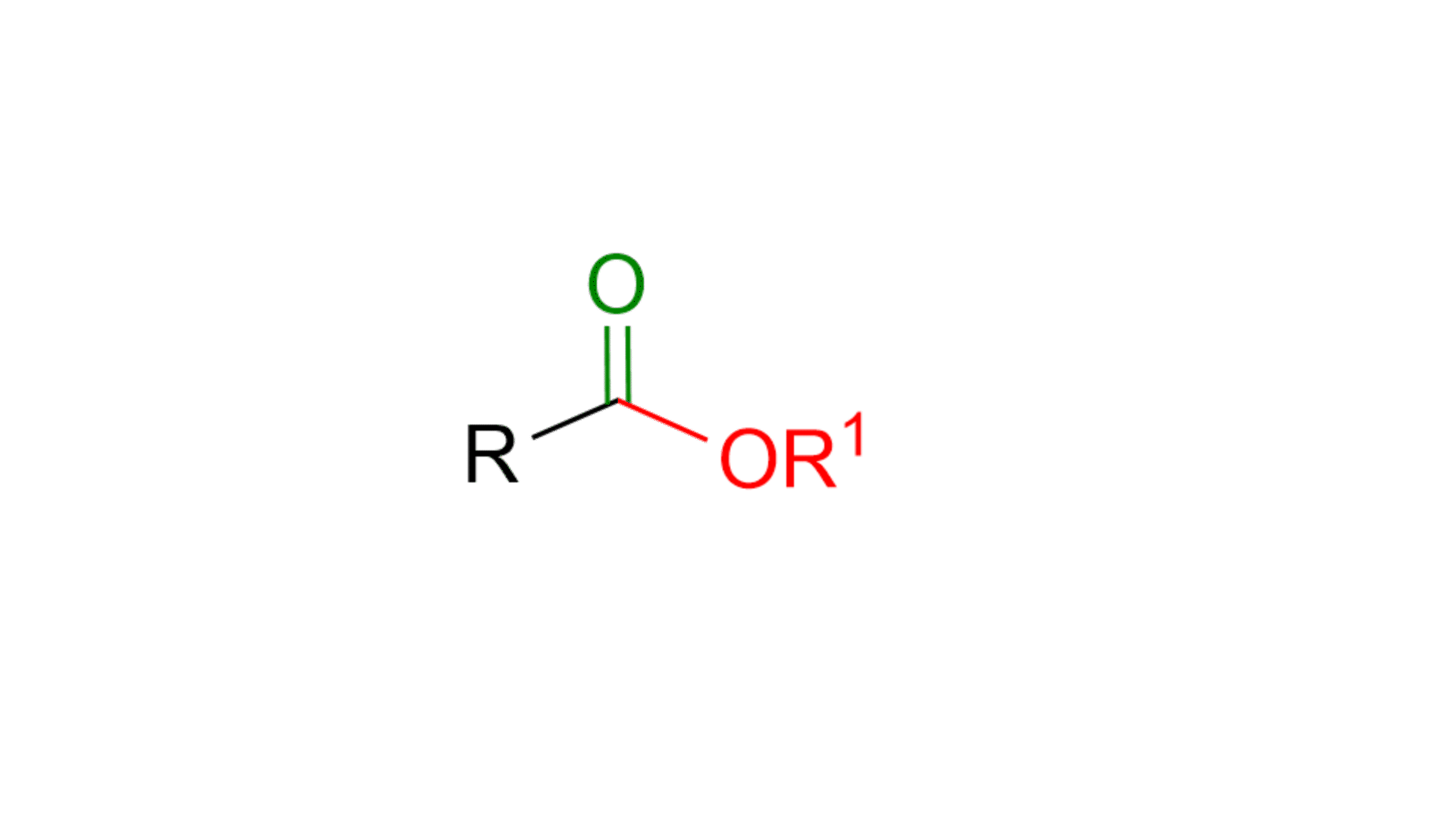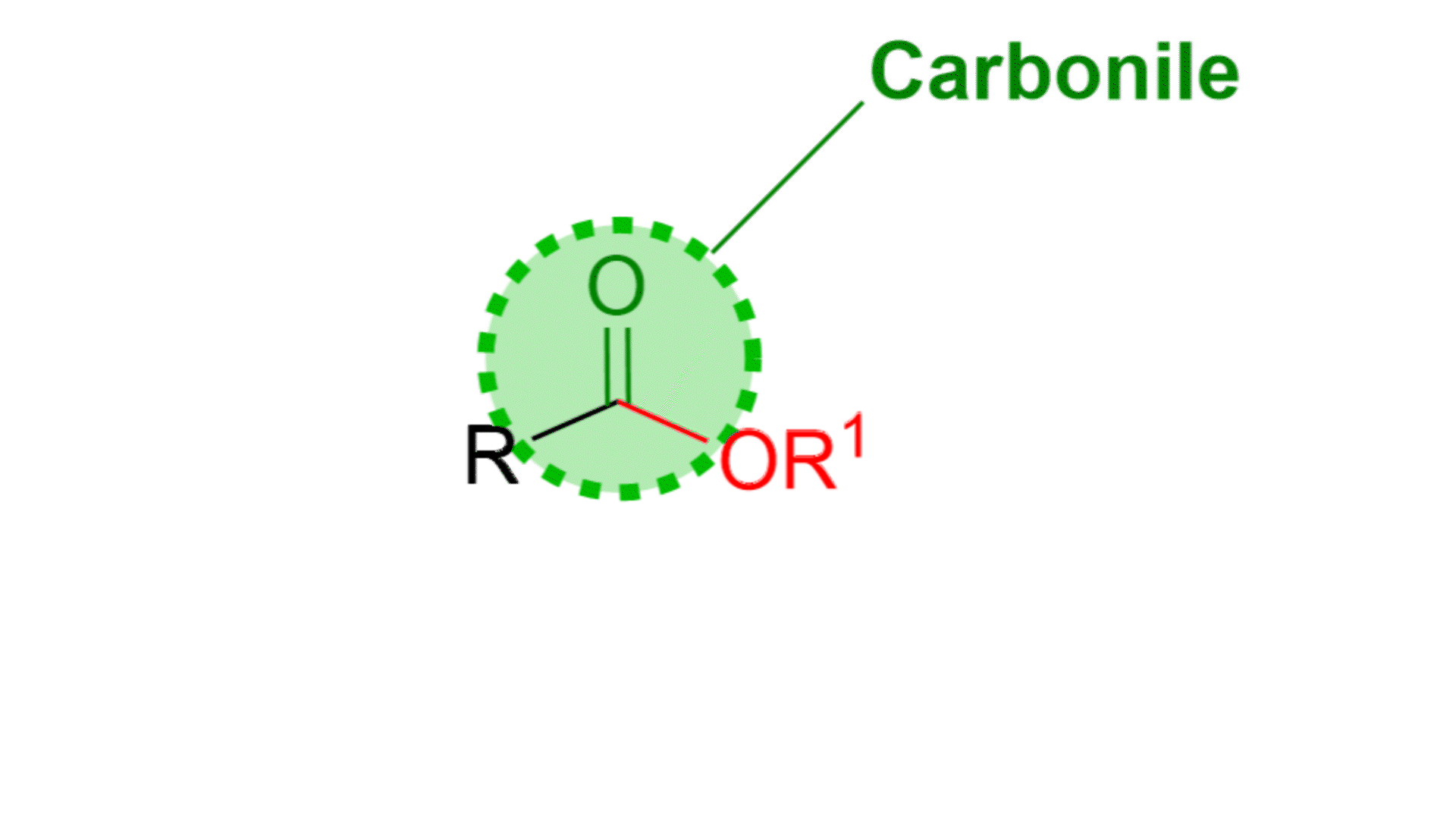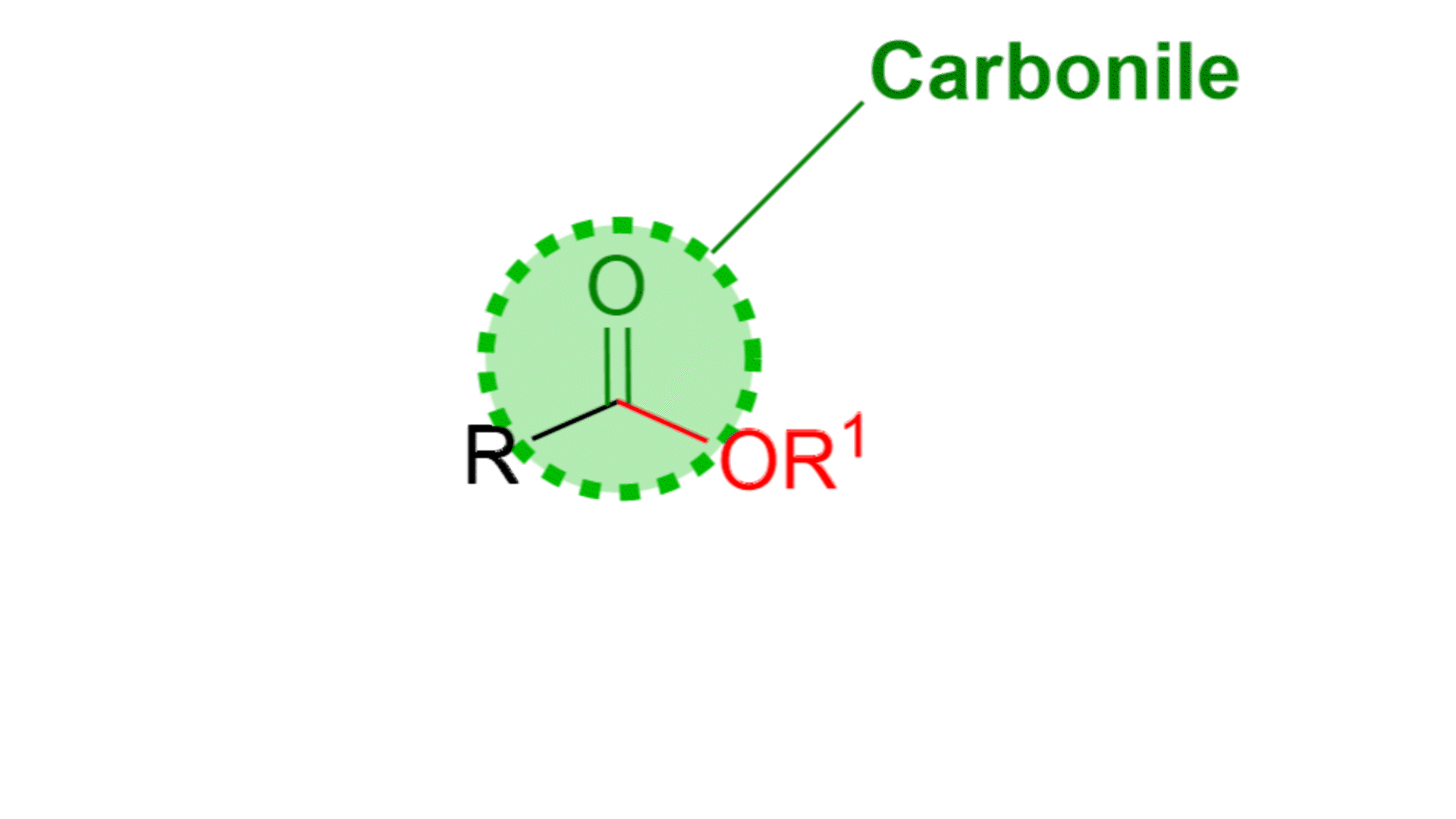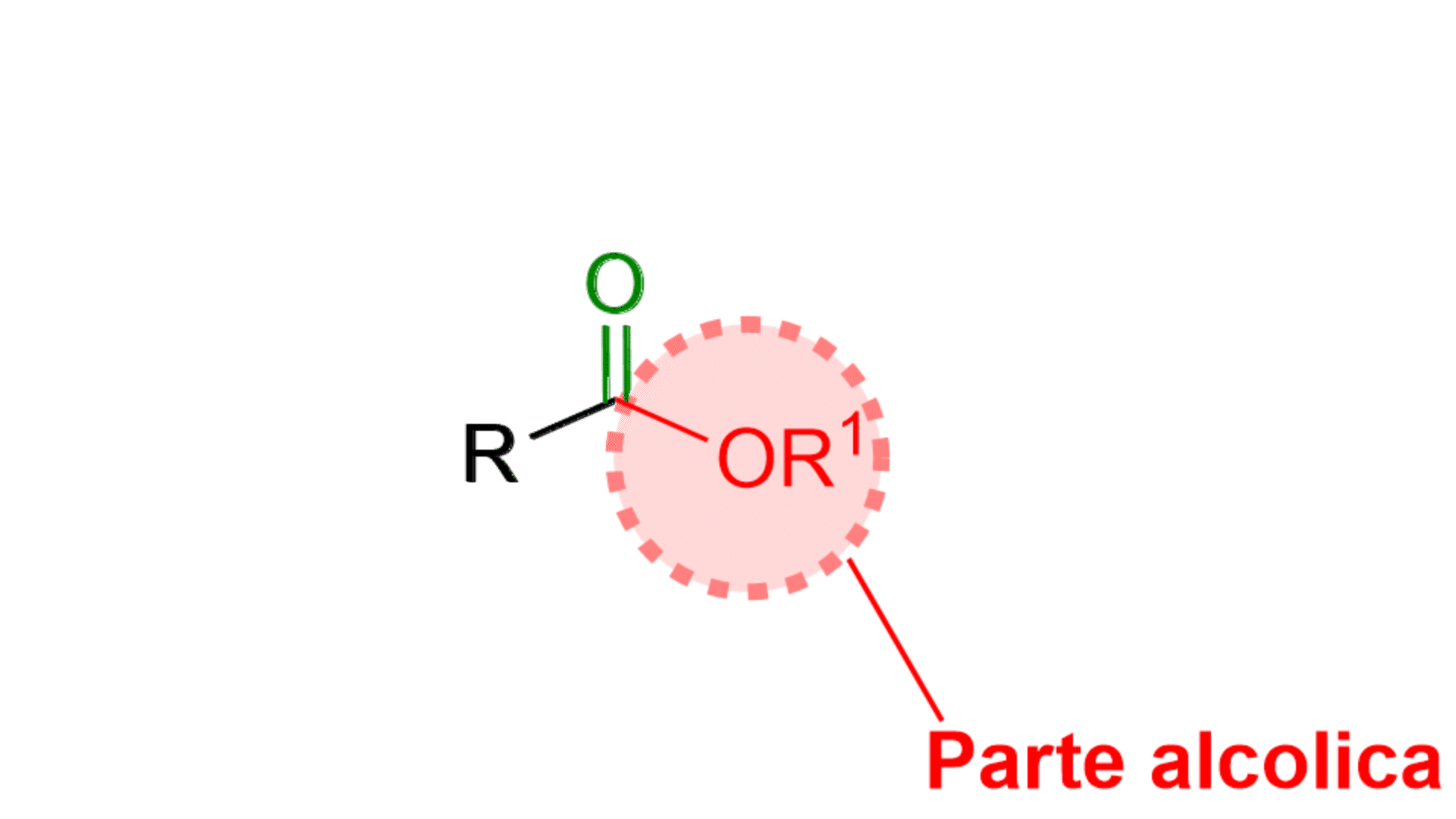
Come si vede dalla figura un estere è composto da un carbonile, C=O, e da una parte alcolica, OR1. Questa parte si chiama alcolica proprio perché deriva da un alcol, R1OH. L’estere ha anche una parte R, che in genere è una catena alchilica o un gruppo aromatico.
Formazione degli esteri
Ma veniamo al fulcro del nostro articolo: come si formano gli esteri?
Ci sono varie reazioni per formare gli esteri, ma quasi tutte sono accumunate dall’avere un acido carbossilico o un suo derivato (es. acil cloruro) come materiale di partenza. Questo non deve sembrare strano, dato che gli esteri sono noti anche come derivati degli acidi.
Dunque a seconda delle condizioni di reazione (es. ambiente acido o basico) e dell’altro reagente affiancato all’acido carbossilico o a un suo derivato, sono note varie reazioni, che elenchiamo di seguito.
Reazione di esterificazione di Fischer
La reazione di esterificazione di Fischer è certamente la più famosa per formare gli esteri. Essa è caratterizzata da:
Materiali di partenza: acido carbossilico (RCOOH) e alcol (ROH).
Condizioni di reazioni: catalisi acida, temperatura alta.
Puoi vedere un esempio di questa reazione in basso.
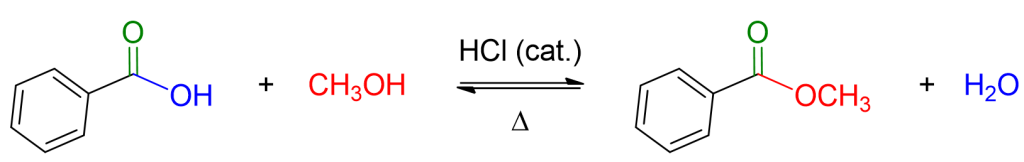
Come puoi notare la reazione è di equilibrio, questo implica che può tornare indietro. Dunque per spingere la reazione verso la formazione dell’estere occorre operare in eccesso di alcol, che talvolta è usato come solvente, o occorre eliminare l’acqua dall’ambiente di reazione. L’eliminazione di acqua può essere fatta sfruttando l’azeotropo toluene/acqua e usando una particolare apparecchiatura nota come trappola di Dean-Stark, che permette la rimozione dell’acqua dall’ambiente di reazione, via via che essa si forma.
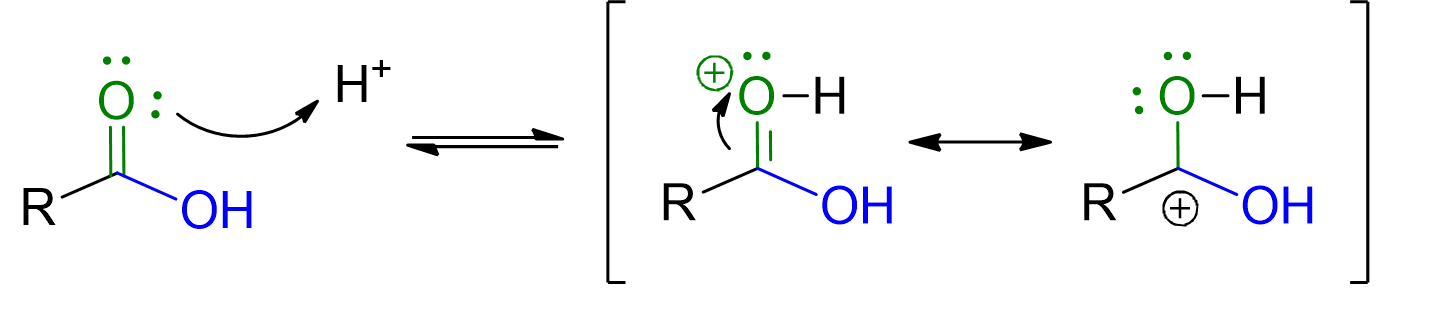
Il meccanismo della reazione è descritto nelle tendine a scorrimento in basso. Tuttavia due sono i principali punti da ricordare:
La catalisi acida serve a rendere il carbonile dell’acido carbossilico più elettrofilico e quindi più facilmente attaccabile dal nucleofilo, ossia l’alcol. Inoltre la protonazione dell’OH dell’acido carbossilico, favorisce l’uscita di questo gruppo come acqua. L’acqua, infatti, è un miglior gruppo uscente rispetto a OH–;
L’ ossigeno della parte alcolica dell’estere formatosi deriva direttamente dall’alcol e non dall’OH dell’acido carbossilico. Questo è stato provato con tecniche di marcatura isotopica. Quindi il meccanismo prevede l’addizione dell’alcol seguita da eliminaione di OH, come acqua.
Protonazione del gruppo carbonilico dell’acido carbossilico. Si forma un intermedio stabilizzato da risonanza che è maggiormente elettrofilo.
L’alcol attacca il gruppo carbonilico dell’estere e forma un intermedio a 4 centri.
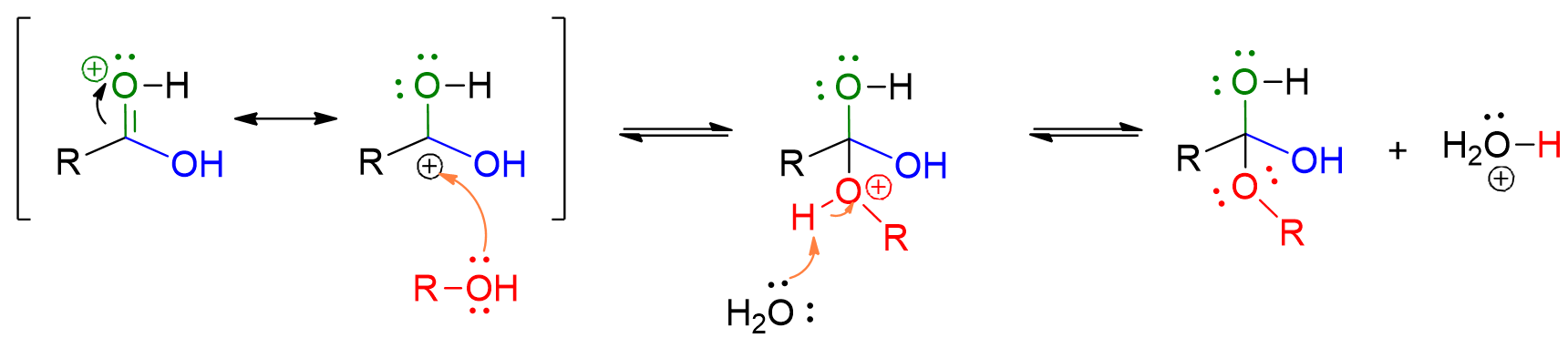
Protonazione dell’OH dell’acido carbossilico che esce come acqua. Si forma così l’estere.
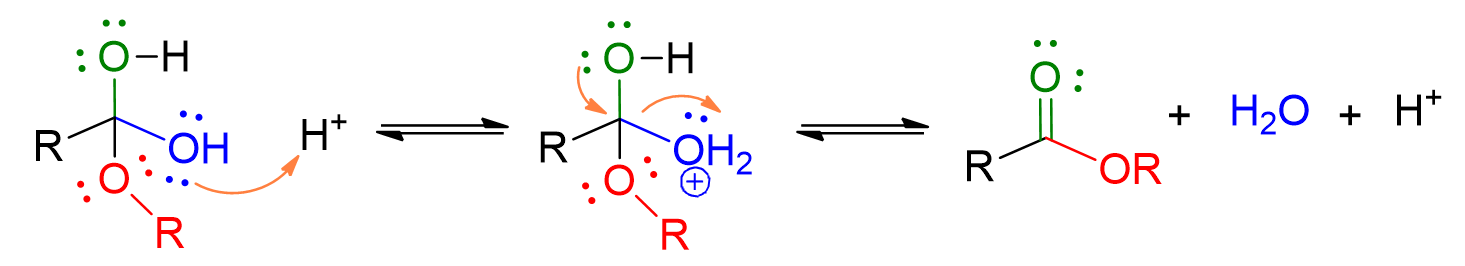
Le reazioni descritte nel meccanismo sopra riportato, sono tutte di equilibrio! È, perciò, importante scrivere tutti gli step con doppia freccia.
In questa reazione gli acidi più comuni impiegati sono H2SO4, acido paratoluensolfonico (p-TosOH), BF3 e vengono aggiunti in quantità catalitiche, ossia poche gocce sono sufficienti. Potenzialmente si può usare qualsiasi acido carbossilico che sia resistente alle condizioni di reazione. Tuttavia gli alcoli usati si limitano a quelli più semplici: MeOH, EtOH, n-PrOH, n-ButOH etc.
Reazione SN2
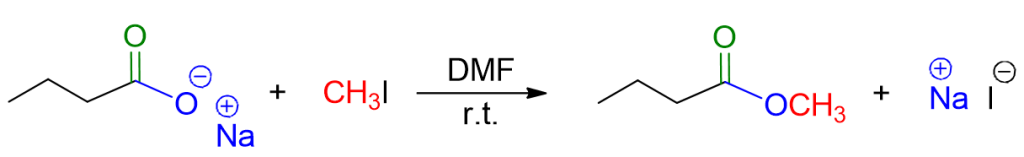
La reazione di sostituzione nucleofila SN2 coinvolge di nuovo un acido carbossilico, ma nella forma di carbossilato. La controparte è questa volta un alogenuro alchilico primario. Dunque la reazione prevede come:
Materiali di partenza: anione carbossilato e alogenuro alchilico primario
Condizioni di reazione: solvente polare aprotico (es. dimetilformammide, DMF, dimetilsolfossido, DMSO).
Nell’immagine sottostante è riportato un esempio.
Il meccanismo di reazione è quello tipico della reazione di sostituzione bimolecolare SN2. Quindi prevede l’attacco del nucleofilo, l’acido carbossilico, sull’alogenuro alchilico con perdita simultanea del gruppo uscente, X–. La reazione avviene in un unico stadio.
Lo ione carbossilato, che funge da nucleofilo, attacca l’elettrofilo, RX, facendogli perdere il gruppo uscente.
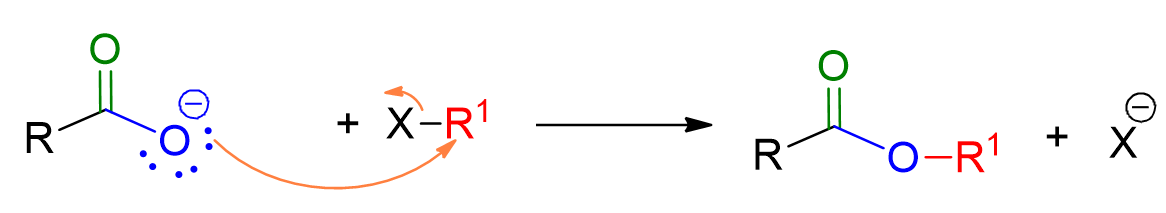
Questa reazione viene fatta solo con alogenuri primari per evitare competizione con la reazione di eliminazione, come tipico in tutte le reazioni SN2.
Reazione acil cloruro con alcol
Un’altra reazione per formare gli esteri coinvolge un cloruro acido e un alcol. Dunque questa volta non c’è il solito acido carbossilico, ma vi è un suo derivato, che è anche il più elettrofilo nella serie dei derivati degli acidi e quindi il più reattivo verso i nucleofili. L’acil cloruro, in realtà, essendo più reattivo può essere impiegato per formare tutti i derivati degli acidi. Non deve quindi sorprendere che venga impiegato per la formazione degli esteri.
Vediamo, dunque, le condizioni di reazione:
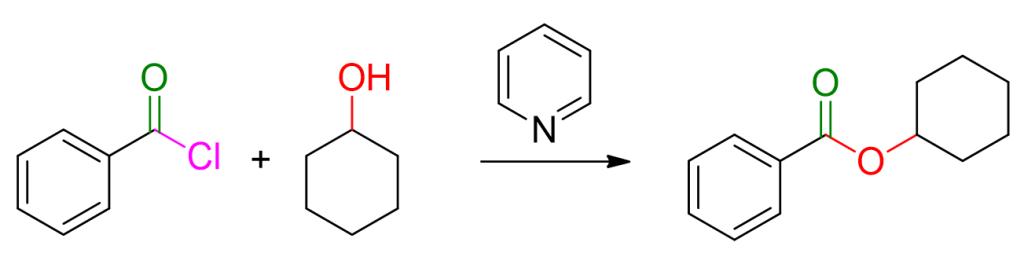
Materiali di partenza: acil cloruro e alcol.
Condizioni di reazione: uso di una base, in genere piridina, per eliminare l’acido cloridrico che si forma nel corso della reazione.
Per un esempio, puoi vedere la reazione riportata in basso.
Il meccanismo della reazione prevede più step, ma essi sono facilmente ricordabili se si pensa che, in genere, i derivati degli acidi reagiscono tramite addizione del nucleofilo ed eliminazione successiva del gruppo uscente.
L’alcol, che funge da nucleofilo, attacca il gruppo carbonilico dell’alogenuro acilico, formando un intermedio a 4 centri.

A questo punto interviene la piridina a deprotonare l’alcol.
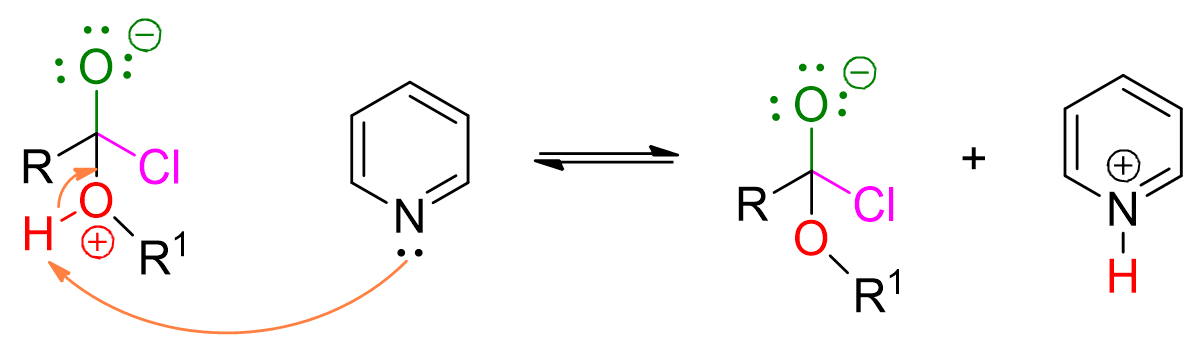
La perdita del cloruro determina la formazione dell’estere. Questo step è irreversibile.
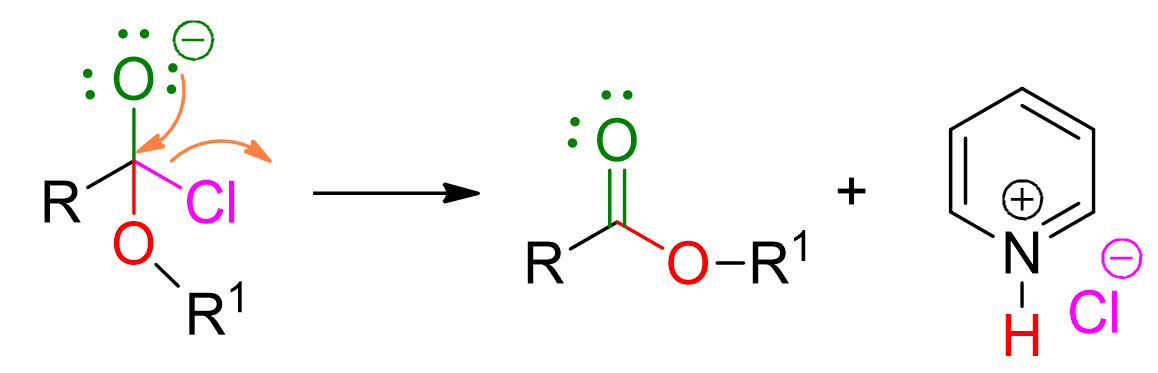
Tra le reazioni elencate per la formazione di esteri, questa è quella più versatile, infatti può essere fatta con svariati alcoli e alogenuri alchilici. Inoltre, ha il vantaggio di essere irreversibile a differenza dell’esterificazione di Fischer. Tuttavia, è bene ricordare che in questa reazione gli alcoli primari reagiscono più velocemente rispetto ai secondari, che a loro volta sono più veloci dei terziari.
Questa lezione

Formazione esteri
€
1.50
Scarica pdf (non modificabile)

Formazione esteri
€
2.50
Scarica docx (modificabile)