Introduzione
In questo articolo vediamo le procedure tipicamente usate in laboratorio per effettuare la reazione di esterificazione di Fischer.
Prima di iniziare ricordiamo brevemente cos’è questa reazione.
La reazione di esterificazione di Fischer è la formazione di un estere a partire da un acido carbossilico e da un alcol, in catalisi acida.
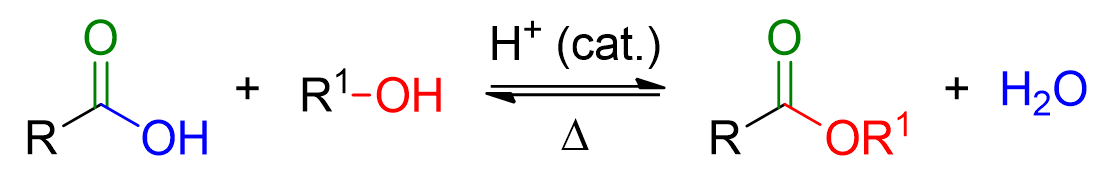
Come si vede dallo schema in alto la reazione di Fisher è di equilibrio e richiede calore per avvenire.
Se non ti ricordi il meccanismo della reazione, lo puoi trovare nel nostro articolo: ”Formazione degli esteri”
Generiche condizioni di reazione
Come già detto, l’esterificazione di Fischer è una reazione di equilibrio, quindi occorrerà operare in condizioni che spostano l’equilibrio verso i reagenti. Tali condizioni sono:
uso di un eccesso di alcol;
eliminazione dell’acqua via via che si forma.
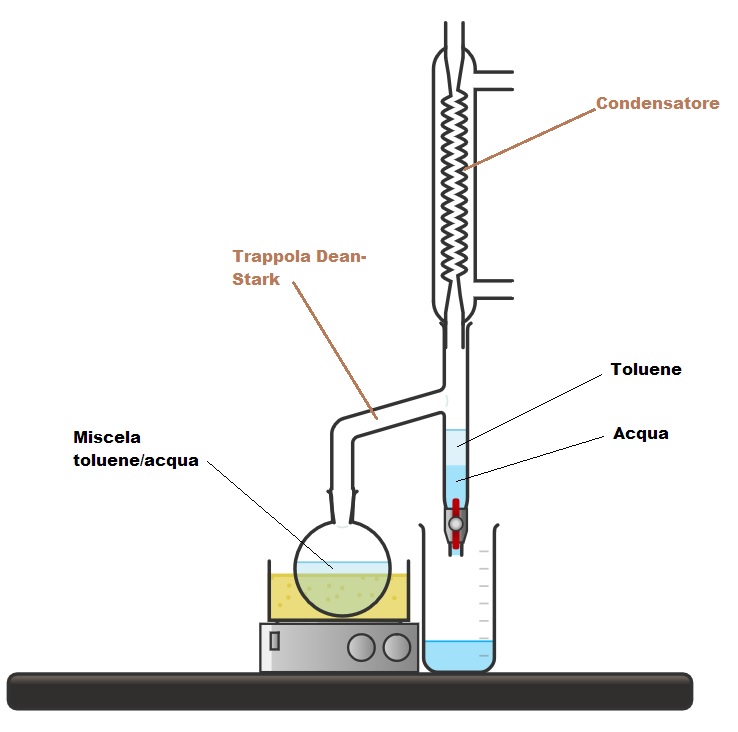
Spesso l’alcol è usato direttamente come solvente in queste reazioni. In alternativa, si può rimuovere l’acqua dall’ambiente di reazione, usando una miscela azeotropica toluene/acqua e la trappola di Dean-Stark.
La figura in basso mostra la tipica apparecchiatura per eseguire la reazione mediante trappola di Dean-Stark.
Vediamo ora i tipici reagenti e temperature impiegate.
Gli alcoli adoperati sono in genere quelli più semplici, come MeOH, EtOH, n-PrOH, n-ButOH etc.
Gli acidi usati come catalizzatori sono solitamente acido solforico (H2SO4), acido paratoluensolfonico (p-TosOH), trifluoruro di boro (BF3).
La reazione è condotta a riflusso, quindi la temperatura sarà impostata in base alla temperatura di ebolizzione del solvente usato.
Procedure tipiche
Dopo aver discusso le caratteristiche generali dell’esterificazione di Fisher, vediamo finalmente come eseguire la reazione in laboratorio. Vengono riportate di seguito alcune procedure trovate in letteratura.
Procedure con H2SO4 come catalizzatore
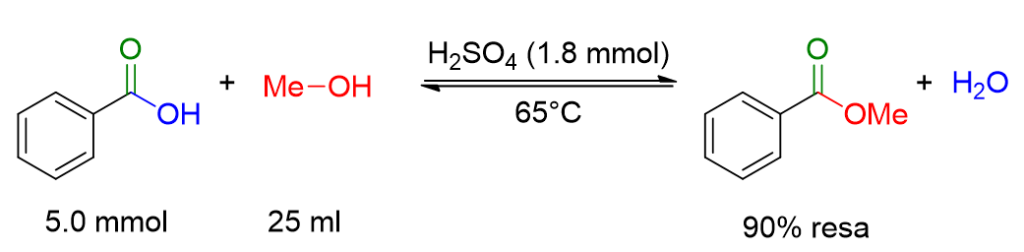
610 mg di acido benzoico sono stati dissolti in 25 ml di metanolo. L’acido solforico concentrato (0.1 ml) è stato aggiunto lentamente e prudentemente alla miscela di reazione. La miscela di reazione è stata mescolata a 65°C fino al completamento della reazione. Il solvente è stato rimosso a pressione ridotta. Il residuo è stato estratto con etile acetato (50 ml) e la fase organica è stata lavata con una soluzione satura di NaHCO3 (2 x 30 ml) e infine con una soluzione satura di NaCl. La fase organica risultante é stata anidrificata su MgSO4 e concentrata a pressione ridotta. Il metil benzoato è stato ottenuto con una resa del 90%.
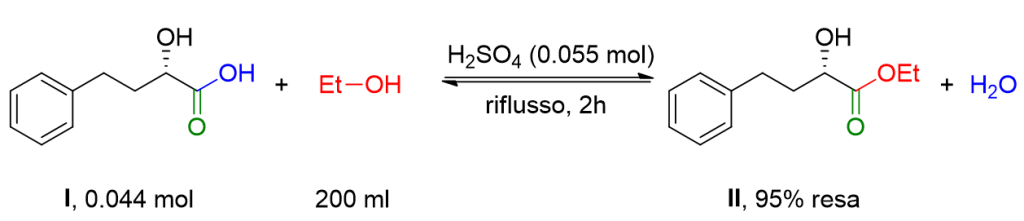
A una soluzione dell’idrossi acido I (8.0 g, 0.044 mol) in etanolo anidro (200 ml), H2SO4 concentrato (3 ml) è aggiunto. La miscela é agitata a riflusso per 2 h. Il solvente è rimosso a pressione ridotta per rimuovere l’eccesso di etanolo e una miscela di H2O (50 ml) e etile acetato (200 ml) è aggiunta. La fase organica è lavata con una soluzione acquosa di NaHCO3 e con una soluzione satura di NaCl, infine è anidrificata su Na2SO4 e filtrata. Il solvente è rimosso mediante Rotavapor per ottenere l’estere II come olio giallo pallido (8.9 g, 95% resa).[1]
Procedure con p-TosOH come catalizzatore
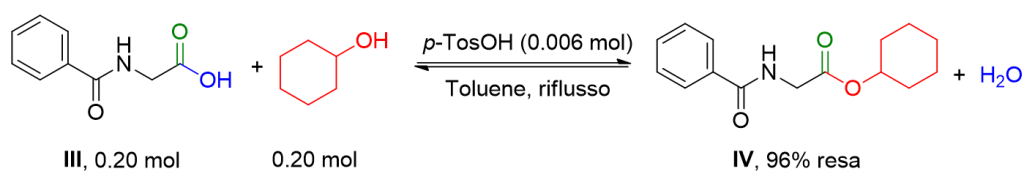
L’acido ippurico III (35.8 g, 0.20 mol) e cicloesanolo (20.0 g, 0.20 mol) sono riscaldati a riflusso con acido paratoulensolfonico (1.0 g) in toluene (200 ml). La reazione è condotta con trappola di Dean-Stark per la rimozione dell’acqua fino a che la quantità di acqua prevista si sia formata (tipicamente 30 h). Dopo raffreddamento del pallone di reazione, si aggiunge EtOAc (200 ml) per diluire. La fase organica ottenuta è lavata due volte con H2O, anidrificata su MgSO4 e filtrata. Il solvente è rimosso mediante Rotavapor e il crudo è ricristallizato da EtOAc/n-hexane (1:1) per ottenere l’estere IV come solido incolore (50.3 g, 96% resa).[2]
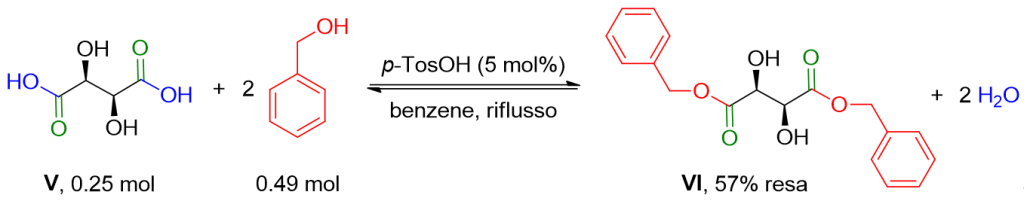
In un pallone a fondo tondo, munito di trappola Dean-Stark con refrigerante, di connesione a bombola di N2, e di magnetino, l’acido d-tartarico V 37.75 g (0.25 mol), benzil alcol 53.0 g (195 mol%) l’acido paratoluensolfonico monoidrato 2.37 g (5 mol%) e 110 ml di benzene sono aggiunti. La miscela di reazione è riscaldata a riflusso fino a completa evoluzione di acqua (20 h) ed è poi riportata a temperatura ambiente. Isoottano (100 ml) è aggiunto e il precipitato formatosi è filtrato e ridissolto in 300 ml di EtOAc. La fase organica è lavata con soluzione acquosa satura di NaHCO3 (2 x 75 ml) e con soluzione satura di NaCl (2 x 50 ml), anidrificata su Na2SO4 e filtrata. Il solvente è rimosso mediante Rotavapor. Il crudo è dissolto in toluene (200 ml) e il prodotto è precipitato per aggiunta di 200 ml di isoottano. Dopo filtrazione e essiccamento mediante alto vuoto, il composto VI, 46.02 g (57% resa), è ottenuto come solido bianco.[3]
Procedure con BF3 come catalizzatore

Un pallone a fondo tondo, munito di refrigerante e di magnetino, è caricato con 33.7 g (0.135 mol) di N-(benzilossicarbonil)- (S)-
prolina VII e 400 mL di metanolo anidro sotto armosfera inerte. Il trifluoruro di boro 24.6 mL (28.4 g, 0.2 mol) è aggiunto alla miscela sotto agitazione. La soluzione risultante é poi riscaldata a riflusso per 1 h. Il solvente è rimosso a pressione risotta e il residuo è agitato vigorosamente con 200 ml di acqua e ghiaccio ed estratto con EtOAc (3 x 100 mL). Gli estratti sono combinati e lavati successivamente con soluzione satura di NaCl, soluzione acquosa di NaHCO3 (1 M) e con soluzione satura di NaCl, anidrificati su Na2SO4 e filtrati. Dopo la rimozione del solvente a pressione ridotta, il risultante olio incolore è portato a secco mediante duplice ridissoluzione in 100 ml di toluene anidro e rimozione del solvente a pressione ridotta. Si ottiene il campione VIII come olio incolore ( 34.2 g, 96% resa).[4]
Riferimenti
[1] Lin, W., He, Z., Jing, Y., Cui, X., Liu, H., & Mi, A. (2001). A practical synthesis of ethyl (R)- and (S)-2-hydroxy-4-phenylbutanoate and d-homophenylalanine ethyl ester hydrochloride from l-malic acid. Tetrahedron-asymmetry, 12(11), 1583–1587. https://doi.org/10.1016/s0957-4166(01)00285-3
[2] Kober, R., Papadopoulos, K., Miltz, W., Enders, D., Steglich, W., Reuter, H., & Puff, H. (1985). Synthesis of diastereo- and enantiomerically pure α-amino-γ-oxo acid esters by reaction of acyliminoacetates with enamines derived from 6-membered ketones. Tetrahedron, 41(9), 1693–1701. https://doi.org/10.1016/s0040-4020(01)96483-x
[3] Bishop, J. K., O’Connell, J. F., & Rapoport, H. (1991). The reaction of thioimides with phosphorus ylides. The Journal of Organic Chemistry, 56(17), 5079–5091. https://doi.org/10.1021/jo00017a017
[4] Corey, E. J., Shibata, S., & Bakshi, R. K. (1988). An efficient and catalytically enantioselective route to (S)-(-)-phenyloxirane. The Journal of Organic Chemistry, 53(12), 2861–2863. https://doi.org/10.1021/jo00247a044
