Introduzione
In questo articolo parliamo della cinetica chimica, un argomento importante di chimica generale, ma che ti accompagnerà anche in tutti i campi della chimica.
Infatti,
la cinetica studia la velocità delle reazioni chimiche.
Tale argomento ha molte applicazioni a livello pratico. Per esempio se siamo un’industria che deve produrre una sostanza e venderla saremmo propensi a produrla nel minor tempo possibile e quindi saremmo interessati a reazioni che avvengano in un tempo ragionevole (da pochi minuti a qualche giorno) mentre escluderemmo le reazioni troppo lente (es. reazioni che impiegano mesi o anni). Allo stesso modo la cinetica è fondamentale anche per i ricercatori, dato che lo studio della cinetica permette di avere informazioni sul meccanismo di una reazione.
In sintesi la cinetica chimica ci permette di avere informazioni su:
- La velocità di una reazione;
- Il meccanismo di reazione.
Definizione imprecisa di velocità (velocità media)
Come anche in fisica, la velocità è sempre la variazione di una qualche proprietà nel tempo. In chimica, per definire la velocità di una reazione, dobbiamo dunque indentificare questa proprietà che varia nel tempo. La risposta non può essere altro che la concentrazione, giacché durante il corso di una reazione la concentrazione dei reagenti diminuisce mentre quella dei prodotti aumenta. Si può scrivere che:
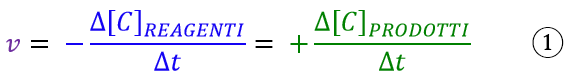
La velocità dunque è la variazione della concentrazione dei reagenti o prodotti (Δ[C]) nel tempo (Δt) in cui la stessa variazione avviene. Si noti il segno meno nel caso in cui la velocità venga espressa con la concentrazione dei reagenti. Questo perché senza tale segno la velocità verrebbe negativa, dato che i reagenti diminuiscono nel tempo e siccome ai chimici non piace l’idea di una velocità con segno meno, allora hanno optato per aggiungere un ulteriore segno negativo, di modo che il risultato fosse positivo. È una semplice convezione, da ricordare a memoria, purtroppo!

Vuoi avere questo articolo offline, per leggerlo comodamente e quando vuoi? Scarica il il pdf o il file docx relativo a questo articolo qui.
Facciamo un esempio per capire l’equazione 1. Supponiamo di avere la seguente reazione:
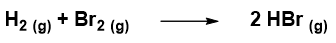
e di aver calcolato che in 200 s la concentrazione molare di Br2 è diminuita da 3,00 mol L-1 a 1.50 mol L -1. La velocità di consumo di Br2 secondo la 1 sarà:
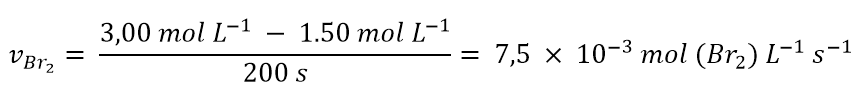
Dunque abbiamo visto che la velocità dipende dalla concentrazione. Vediamo ora come scrivere la velocità per una reazione generica del tipo:

La velocità di reazione sarà espressa:
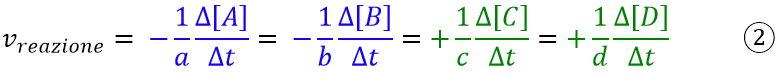
La ragione per cui bisogna dividere per i coefficienti stechiometrici è la stessa che nel caso dei rapporti ponderali nelle reazioni chimiche, dove per la stessa generica equazione si può scrivere l’espressione:
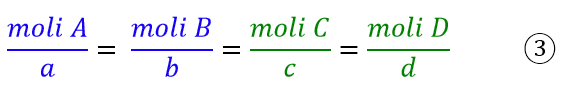
Quindi se volessi sapere le moli di C formate a partire dalle moli di A, dovrei dividere le moli di A per il coefficiente stechiometrico a e poi moltiplicare il risultato per il coefficiente c. Siccome le velocità in chimica dipendono dalla concentrazione, che dipende a sua volta dalle moli in gioco, allora anche la velocità di formazione o consumo di una specie chimica dipenderà dai coefficienti stechiometrici, che andranno pertanto considerati.
A questo punto, onde evitare confusioni, è conveniente distinguere tra:
- velocità di reazione che è indipendente dal coefficiente stechiometrico ed è uguale per tutte le specie (equazione 2);
- velocità di formazione/consumo rispetto a una specie chimica, che dipende dai coefficienti stechiometrici.
L’esempio che segue chiarirà la distinzione tra queste due velocità.
Facciamo un esempio per capire meglio l’equazione 2. Consideriamo la seguente reazione:
La velocità di formazione di NH3 è stata riportata come 1,15 (mol NH3) L-1 h-1, calcoliamo la velocità in funzione di H2, la velocità in funzione di N2 e la velocità di reazione. Usando l’equazione 2 e considerando che ogni 2 moli di NH3, 3 moli di H2 vengono consumate, si ricava:
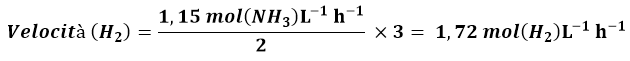
In modo simile la velocità di consumo di N2 sarà data da:
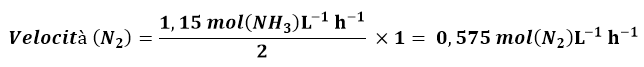
La velocità di reazione, secondo la 2, si potrà calcolare dalla velocità di formazione di NH3 diviso il suo coefficiente stechiometrico:
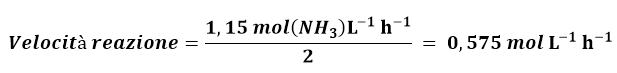
Analogamente potrei calcolare la velocità di reazione dividendo la velocità di consumo di N2 per il suo coefficiente stechiometrico e similmente se considero il consumo di H2.
Definizione precisa di velocità (velocità istantanea)
Se ci ricordiamo alcune basi di cinetica in fisica, facilmente possiamo capire che l’equazione 1 è valida solo per velocità costanti. Tuttavia le velocità delle reazioni chimiche non sono costanti, ma tendono a rallentare man mano che si consumano i reagenti.
Infatti nei due grafici sottostanti si può notare il tipico andamento della concentrazione dei reagenti (sinistra) o dei prodotti (destra) con il passare del tempo.
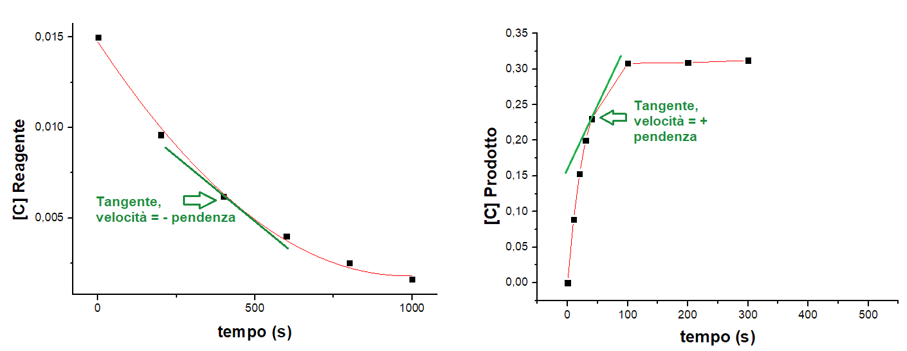
Nel grafico a sinistra, si vede come la concentrazione dei reagenti diminuisce dapprima velocemente e poi sempre più lentamente. Similmente la concentrazione dei prodotti, grafico a destra, aumenta all’inizio velocemente e poi sempre più lentamente.
Per seguire l’andamento della velocità basta tracciare una retta tangente al punto di interesse, come mostrato dalla retta verde in figura 1. Il coefficiente angolare di tale retta, ossia la sua pendenza, determina la velocità in quel punto. Nel caso dei reagenti, la pendenza sarà negativa (la retta inclina verso sinistra), mentre per i prodotti sarà positiva (la retta inclina verso destra).
Per sapere le velocità in tutti i punti della curva, bisognerà tracciare una tangente per ognuno di questi punti. Tale operazione in matematica equivale al concetto di derivata prima. Dunque possiamo definire la velocità istantanea di una reazione chimica come:
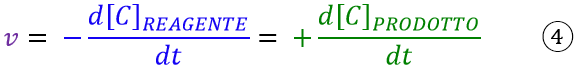
la derivata della concentrazione dei reagenti o dei prodotti rispetto al tempo.
Anche questa volta, nel caso di una reazione generica, le varie velocità delle specie chimiche in gioco saranno in relazione tra loro secondo la:
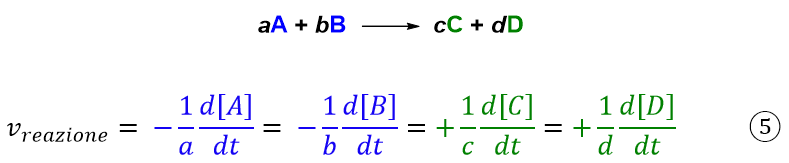
In sintesi possiamo definire la velocità di una reazione come la derivata rispetto al tempo della concentrazione di una delle specie che prendono parte alla reazione divisa per l’appropriato coefficiente stechiometrico e trasformata in numero positivo.
Legge cinetica
L’equazione 5 non ha molta utilità dal punto di vista pratico ed è difficile da risolvere essendo un’equazione differenziale.
Dunque la 5 si può usare come definizione di velocità, ma dal punto di vista pratico i chimici usano la legge cinetica: un’equazione che si trova solo sperimentalmente, ossia misurando le concentrazioni dei reagenti e prodotti nel tempo. La legge cinetica è espressa nel seguente modo:
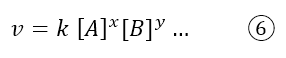
Dove k è la costante cinetica che è indipendente dalle concentrazioni, ma dipende dalla temperatura; [A] e [B] sono le concentrazioni dei reagenti (ma talvolta anche le concentrazioni dei prodotti possono comparire) e x e y sono dei coefficienti che vengono trovati sperimentalmente. Essi non corrispondono ai coefficiente stechiometrici della reazione complessiva, ma ai coefficienti stechiometrici dello step elementare (argomento che vedremo nel prossimo articolo). L’equazione è scritta con i puntini sospensivi perché è sperimentale, quindi non si può sapere esattamente quanti e quali reagenti influenzeranno la cinetica.
Per esempio la reazione di decomposizione dell’acetaldeide è la seguente:
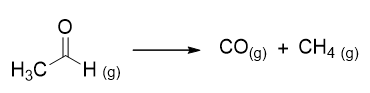
La legge cinetica trovata sperimentalmente risulta:
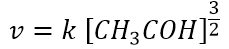
Come si vede la cinetica dipende solo dalla concentrazione dell’acetaldeide; inoltre il coefficiente 3/2 non ha nulla a che fare con il coefficiente stechiometrico (pari a 1) della reazione complessiva bilanciata, ma è un valore da trovare sperimentalmente.
Tornando alla legge cinetica generica 6, l’esponente x individua l’ordine di reazione della specie chimica A, mentre y individua l’ordine di reazione del reagente B. L’ordine complessivo di reazione è dato dalla somma dei coefficienti: x+y.
Facciamo un esempio. Data la reazione seguente:
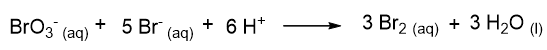
si trova sperimentalmente che la legge cinetica è del tipo:
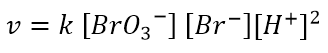
Questo implica che l’odine di reazione rispetto a BrO3– e Br– è 1, mentre l’ordine di reazione rispetto a H+ è 2. L’ordine complessivo di reazione è 4.
L’ordine di reazione può essere anche una frazione, come visto già nel caso della decomposizione dell’acetaldeide, dove l’ordine rispetto all’acetaldeide è 3/2, che coincide anche con l’ordine di reazione.
Ci sono inoltre reazioni con legge cinetica di ordine zero; in tal caso la velocità è indipendente dalla concentrazione di qualsiasi specie in soluzione ed è costante. Come esempio si può usare la decomposizione della fosfina (PH3) su tungsteno riscaldato a alta pressione, con la seguente legge cinetica:
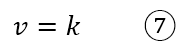
L’ordine complessivo della reazione è nullo. Una legge cinetica di ordine zero è possibile solo per le reazioni che avvengono in fase eterogenea.
Determinazione della legge cinetica
Come si determina la legge cinetica nella pratica?
Ci sono due metodi: il metodo dell’isolamento e il metodo delle velocità iniziali.
Il primo metodo consiste nel usare un eccesso di tutti i reagenti tranne uno. Per esempio data una reazione generica tra una specie A e una specie B, se metto B in forte eccesso, con buona approssimazione potrò considerare la concentrazione di B costante per tutta la reazione. Questo mi dà la possibilità di inglobare [B] nella costante cinetica e scrivere:
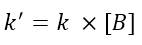
Ipotizzando una legge cinetica del tipo v = k[A][B], siccome ora la concentrazione di B è costante, potremmo riscrivere l’equazione come segue:
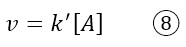
Tale legge cinetica è definita legge cinetica di ordine pseudoprimo, appunto perché il reagente B è stato volutamente reso costante, modificando la reale legge cinetica.
Con il metodo dell’isolamento, la legge cinetica si trova vedendo l’andamento della velocità rispetto a ogni reagente isolato a turno, mentre si mantengono le altre sostanze in eccesso. Nel nostro esempio si isola A mentre si mantiene in eccesso B e poi si isola B mentre si mantiene in eccesso A.
Invece, il metodo delle velocità iniziali, che spesso è usato insieme al metodo dell’isolamento, si applica misurando la velocità iniziale della reazione rispetto a concentrazioni diverse dei reagenti. Ritornando alla nostra reazione generica di A che reagisce con B, possiamo scrivere che la legge cinetica rispetto a A sia:
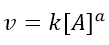
La velocità iniziale (v0) sarà quindi data dalla concentrazione iniziale di A, secondo la:
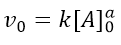
Se passiamo ai logaritmi, otteniamo l’equazione di una retta:
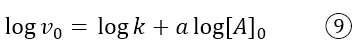
con intercetta log k e pendenza a, l’ordine della reazione rispetto a A. Simile considerazione possiamo fare per B.
Quindi, con questo secondo metodo, si registrano le velocità iniziali della reazione, mantenendo costante la concentrazione di B, ma variando quella di A; con i valori ottenuti si costruisce la retta secondo l’equazione 9 e si trova la pendenza di a che corrisponde all’ordine della reazione rispetto a tale reagente. Lo stesso si fa con B: si mantiene la concentrazione di A costante e si misura la velocità iniziale della reazione a varie concentrazioni iniziali di B. Si costruisce la retta secondo l’equazione che questa volta contempla [B]:
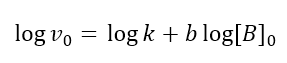
La pendenza di questa retta darà l’ordine di reazione rispetto a B.
Esercizio 1
Facciamo un esempio. Prendiamo la reazione
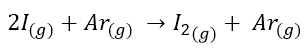
La reazione è stata studiata dapprima mantenendo fissa la [Ar] e monitorando la velocità iniziale a varie concentrazioni iniziali di I secondo i dati esposti nella tabella seguente.

Poi è stata mantenuta costante la [A] e si sono misurate le velocità iniziali a varie concentrazioni di B iniziali. I dati ottenuti sono riportati nella seguente tabella:

Per ricavare l’ordine di reazione rispetto a entrambe le specie, si deve riportare in grafico il log della velocità iniziale, v0, rispetto al log della concentrazione iniziale di I e poi costruire un secondo grafico rispetto alla concentrazione iniziale di Ar. Si ottengono le seguenti rette:
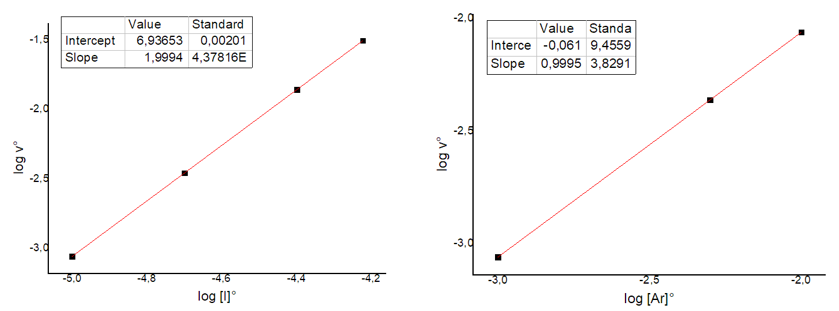
Dalla pendenza delle rette ottenute (vedi slope nella tabella annessa al grafico) si ricavano i valori di a e b, ossia gli ordini di reazione. Nel caso dello iodio, l’ordine di reazione è 2, mentre nel caso dell’argon, l’ordine è 1. Per cui possiamo scrivere la legge cinetica (iniziale) complessiva come segue:
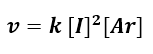
Il metodo delle velocità iniziali potrebbe però non essere preciso nel caso in cui i prodotti influenzino la cinetica. Pertanto dopo aver ottenuto la legge cinetica, questa andrebbe sempre confrontata con i dati sperimentali relativi alle concentrazioni di tutte le specie coinvolte nella reazione.
L’esercizio mostrato sopra, tuttavia, non è uno dei tipici esercizi da svolgere durante gli esami di chimica perché molto probabilmente non si potrà usare un computer per disegnare la retta e calcolarne il coefficiente angolare. Dunque in seduta di esame ci troveremo davanti un esercizio molto simile al precedente, ma da svolgere in maniera diversa. Vediamo un esempio sotto.
Esercizio 2
Per la reazione generica A + B + C → prodotti si sono ricavati i dati seguenti
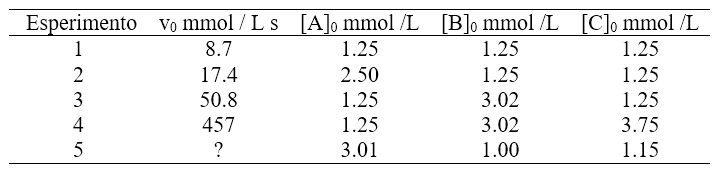
a) Formulare la legge cinetica della reazione;
b) Stabilire l’ordine della reazione;
c) Determinare la costante cinetica;
d) Prevedere la velocità della reazione nell’esperimento 5;
Per determinare la legge cinetica (punto a) bisogna dapprima calcolare l’ordine di reazione rispetto a ogni reagente.
Iniziamo dal reagente A. Come si vede dalla tabella gli esperimenti 1 e 2 possono essere usati per questo calcolo, perché le concentrazioni iniziali di B e C sono fisse mentre quelle di A variano. Quindi da questi due esperimenti posso trarre informazioni sull’influenza di A nella cinetica scrivendo l’equazione:
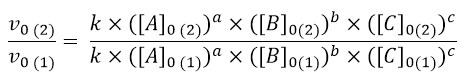
Siccome la [B] e [C] nell’esperimento 1 e 2 sono uguali, si possono eliminare, così anche la costante k. Quindi l’equazione diventa:
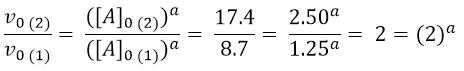
In questo caso è facile capire che il valore di a è 1. Passiamo quindi a determinare l’ordine di reazione rispetto a B. A tal fine si può usare l’esperimento 1 e 3, dove [B] varia, mentre [A] e [C] sono costanti.
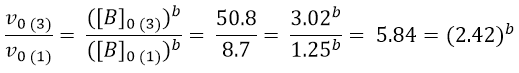
Per ottenere il valore di b si può ricorrere ai logaritmi:
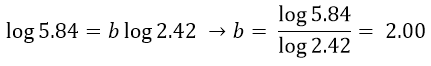
Resta da calcolare l’ordine di reazione rispetto a c. Questa volta confronteremo l’esperimento 4 e 3.
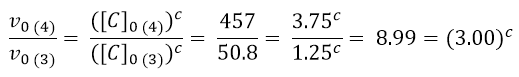
Come fatto precedentemente, usiamo i logaritmi per ottenere il valore di c:
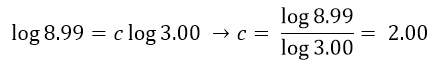
Avendo ottenuto l’ordine di reazione rispetto a ogni reagente possiamo scrivere l’equazione cinetica:
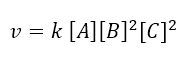
L’ordine complessivo della reazione (punto b dell’esercizio) è dato dalla somma di tutti gli ordini di reazione rispetto alle specie chimiche determinanti la cinetica; quindi l’ordine di reazione risulta a + b + c = 1 + 2 + 2 = 5
Per calcolare la costante cinetica (punto c) basterà prendere alcuni dei dati in tabella, inserirli all’interno dell’equazione cinetica ottenuta e ricavare k. Per esempio prendiamo i dati relativi all’esperimento 1, avremo:
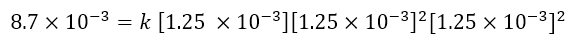
Da cui si ricava facilmente k:
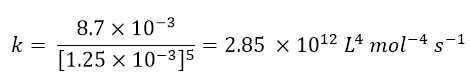
Infine, per ricavare la velocità della reazione nell’esperimento 5 (domanda d), basterà inserire tutti i dati dell’esperimento 5 e la costante cinetica all’interno della legge cinetica:
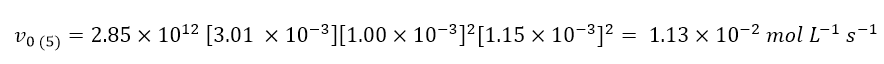
Questa lezione

Cinetica
€
1.00
Trovi anche il diagramma di flusso
Scarica pdf (non modificabile)

Cinetica
€
2.00
Trovi anche il diagramma di flusso
Scarica docx (modificabile)


