Introduzione
In questo articolo impareremo come eseguire le reazioni di homocoupling direttamente in laboratorio.
In particolare, esamineremo le procedure standard per l’homocoupling di alogenuri arilici o triflati utilizzando catalizzatori a base di rame (Cu), palladio (Pd) e nichel (Ni).
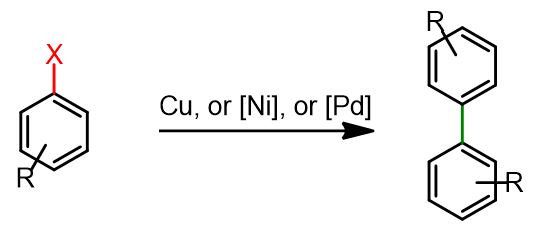
Homocoupling con Cu come catalizzatore – La reazione di Ullmann
Generiche condizioni di reazione
La reazione di homocoupling degli alogenuri arilici catalizzata dal rame è comunemente conosciuta come reazione di Ullmann. Abbiamo discusso di questa trasformazione nei nostri articoli precedenti: Ullmann Coupling – La prima pubblicazione e Ullmann Coupling – Una panoramica. Puoi fare riferimento a entrambi per una comprensione approfondita di questa reazione.
In questo articolo, tuttavia, intendiamo mettere in evidenza le condizioni generali di reazione tipicamente impiegate per la reazione di homocoupling di Ullmann.
Nello specifico, la reazione di Ullmann viene solitamente condotta utilizzando:
Quantità stechiometriche di rame metallico (Cu⁰);
Temperature alte (in genere sopra i 200°C);
Ioduri e bromuri arilici come i più comuni substrati.
La classica reazione di Ullmann veniva originariamente eseguita senza alcun solvente, semplicemente riscaldando polvere di rame con l’alogenuro arilico fino al punto di ebollizione dell’alogenuro, finché la reazione non giungeva a completamento. Approcci più moderni, tuttavia, raccomandano l’uso di solventi come il DMF. Infatti, è ormai ampiamente accettato che il DMF possa facilitare l’ homocoupling di Ullmann a temperature più basse e con un minor carico di catalizzatore.
Sono state proposte diverse modifiche per migliorare ulteriormente l’efficienza della reazione, tra cui:
L’uso di polvere di rame attivata — in particolare rame appena preparato da CuI e potassio — che consente alla reazione di avvenire a temperature significativamente più basse (circa 85 °C);
L’applicazione di irradiamento a ultrasuoni, che può accelerare sensibilmente la velocità della reazione.
Per quanto riguarda la reattività degli alogenuri arilici, i substrati contenenti gruppi elettron-attrattori in posizione orto rispetto all’alogeno sono generalmente più reattivi. Al contrario, gli alogenuri arilici sostituiti con gruppi funzionali come –OH, –NH₂ o –COOH possono interferire con la reazione introducendo ulteriori siti di coordinazione per il rame, limitando così l’efficienza dell’ homocoupling.
Nella sezione seguente, vengono descritte in dettaglio le procedure tipiche per l’ homocoupling di Ullmann.
Procedure tipiche con il Cu
Dopo aver discusso le caratteristiche generali della trasformazione di Ullmann, vediamo infine come eseguire la reazione in laboratorio. Di seguito sono riportate alcune procedure tratte dalla letteratura.
Reazione classica di Ullmann
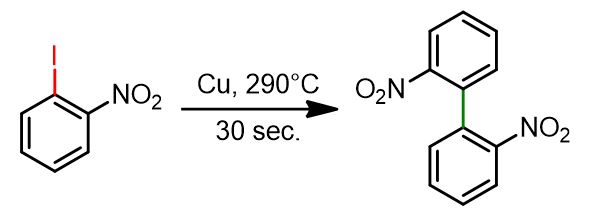
2-Iodonitrobenzene (249 mg, 1,0 mmol) è stato posto in una provetta da 15 cm insieme a polvere di rame (191 mg, 3,0 mmol) e sabbia (200 mg). La miscela risultante è stata riscaldata in un bagno di sabbia a 350 °C, al di sopra del punto di ebollizione del 2-iodonitrobenzene (circa 290 °C), per 20–30 secondi. Durante la reazione, il 2-iodobenzonitrile si è fuso e ha iniziato a bollire. Dopo il raffreddamento, il residuo secco è stato sottoposto a cromatografia su colonna per la purificazione, utilizzando un gradiente da diclorometano:esano (30:70) a diclorometano:acetato di etile (90:10). Il prodotto finale è stato ottenuto con una resa dell’80–90%. [1]
Reazione di Ullmann CON Cu in DMF
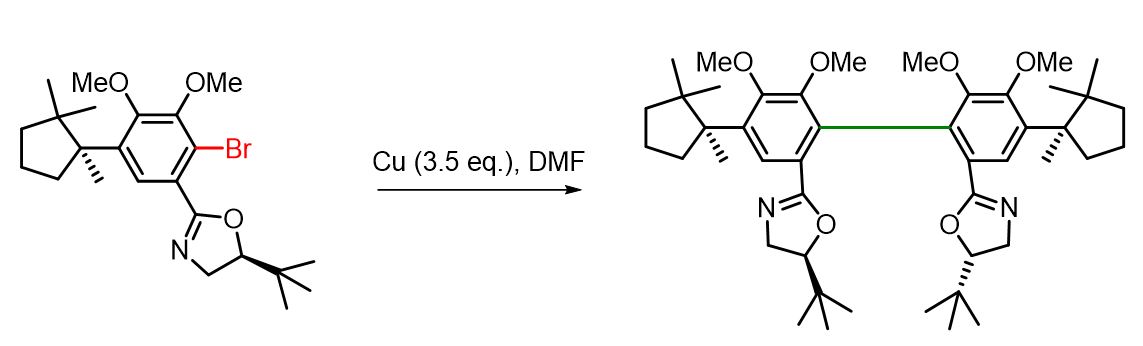
(S)-tert-Leucinol-o-bromoaryloxazoline (300 mg, 0,66 mmol) è stato posto in un pallone da 10 mL insieme a polvere di rame fresca attivata (150 mg, 2,3 mmol) e DMF (1 mL). La miscela è stata agitata e riscaldata a 95 °C per 8 ore. Successivamente è stata diluita con altri 5 mL di DMF e all’apparato è stato collegato un condensatore a riflusso. La miscela di reazione è stata ulteriormente riscaldata a riflusso per 3 giorni. Dopo il raffreddamento, la miscela è stata filtrata su cotone per rimuovere il rame in eccesso. Il filtrato è stato versato in acqua ed estratto con etere dietilico (3×). Le fasi organiche combinate sono state lavate con acqua (2×) e soluzione salina, essiccate su Na₂SO₄ anidro e concentrate sotto vuoto. Il prodotto grezzo è stato purificato mediante cromatografia flash su colonna (50% EtOAc/Esano), ottenendo il complesso biaril–rame. Questo complesso è stato disciolto in etere e lavato con NH₄OH acquoso (2×) e soluzione salina. Le fasi organiche sono state essiccate su Na₂SO₄ e concentrate sotto vuoto, ottenendo il prodotto desiderato come unico atropoisomero con una resa del 64% (158 mg).[2]
Homocoupling con Ni come catalizzatore
Generiche condizioni di reazione
Le prime pubblicazioni sull’uso del nichel nelle reazioni di homocoupling riportavano l’uso di quantità stechiometriche di Ni(0) in presenza di un legante. La reazione mostrata di seguito è un esempio rappresentativo.
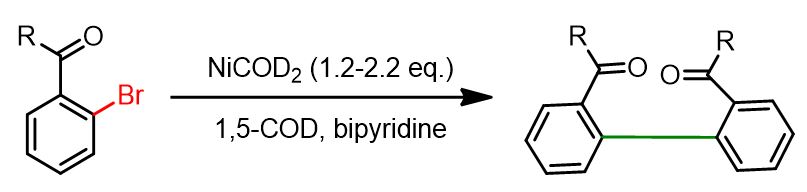
Tuttavia, questo approccio presentava due principali svantaggi: la necessità di utilizzare quantità stechiometriche di nichel e l’obbligo di operare in una glovebox, poiché i catalizzatori Ni(0) sono generalmente instabili in condizioni aerobiche.
Per superare queste limitazioni, sono state sviluppate strategie alternative — in particolare l’uso di precursori Ni(II), ridotti in situ alla specie attiva Ni(0). Questo progresso ha eliminato la necessità della glovebox, ma richiedeva ancora quantità stechiometriche di Ni(II). Tra i vari agenti riducenti testati, la polvere di zinco si è rivelata la più efficace. La reazione riportata di seguito ne è un esempio rappresentativo.
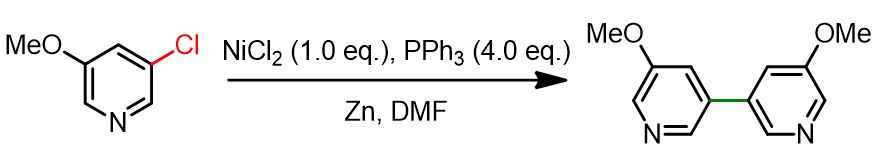
Oggi le reazioni di homocoupling catalizzate dal nichel possono essere eseguite utilizzando quantità catalitiche di specie Ni(II), alle seguenti condizioni generali:
Un agente riducente per convertire Ni(II) nella forma attiva Ni(0). La polvere di zinco è l’agente riducente più comunemente usato, anche se sono stati riportati altri sistemi, come LiH in presenza di una base come t-BuOLi;
Temperature di reazione moderate, tipicamente nell’intervallo 50–100 °C.
Quando si utilizza lo zinco come agente riducente, spesso vengono aggiunti sali di ioduro come additivi, poiché si ritiene che gli ioni ioduro accelerino la reazione.
Nella sezione seguente vengono presentate procedure tipiche per reazioni di homocoupling catalizzate da Ni, offrendo preziose indicazioni su come eseguire praticamente queste reazioni in laboratorio.
Procedure tipiche con il Ni
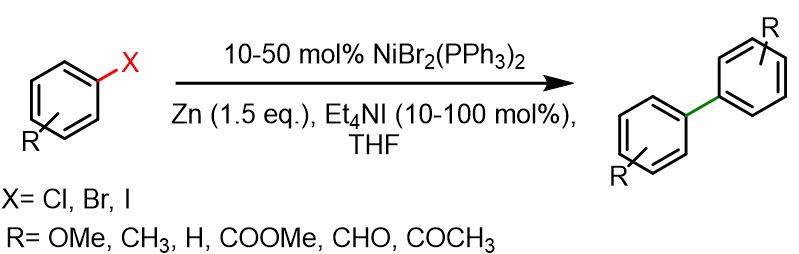
In un pallone a fondo tondo da 50 ml con due colli, sono stati inseriti sotto atmosfera di Ar NiBr2(PPh3)2 (0,5-2,5 mmol), polvere di Zn (7,5 mmol) ed Et4NI (0,5-5 mmol). Successivamente è stato aggiunto THF anidro e la miscela è stata agitata per 30 minuti a temperatura ambiente. Poi è stata aggiunta la soluzione di alogenuro arilico (5 mmol) in THF (5 ml), precedentemente purgata con Ar, e la miscela è stata agitata per 4-20 ore a 50 °C. Si è effettuata la filtrazione per separare il precipitato inorganico, seguita da un lavaggio con benzene; le fasi organiche combinate sono state evaporate sotto vuoto e il residuo ottenuto è stato purificato mediante cromatografia su colonna su gel di silice (50 g). Le rese tipiche del biarile erano comprese tra il 57% e il 99%.[3]
Nella seguente reazione, il catalizzatore a base di Ni promuove l’homocoupling di triflati arilici in presenza di polvere di zinco come agente riducente. La reazione procede in modo più efficiente con gruppi elettron-donatori rispetto a quelli elettron-attrattori. I triflati arilici che portano sostituenti CN o Cl tendono a formare sottoprodotti a causa dell’attivazione dei corrispondenti gruppi funzionali (rispettivamente gruppi CN e Cl).
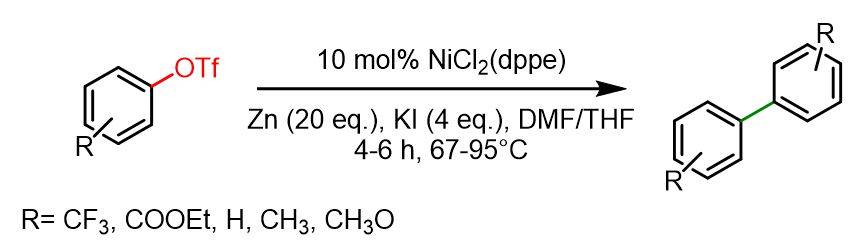
A una miscela di polvere di zinco attivata (3,95 g, 60,0 mmol), KI (2 g, 12 mmol) e NiCl2(dppe) (0,158 g, 0,3 mmol) sono stati aggiunti THF e DMF anidri (1 ml + 1 ml). Successivamente è stato aggiunto p-R-triflate arilico (3 mmol). La miscela di reazione è stata riscaldata a riflusso a 67 °C o 95 °C per 4-6 ore. Successivamente è stata idrolizzata con soluzione satura di NH4Cl ed estratta con etere dietilico. Quando necessario, è stata effettuata la cromatografia su colonna su gel di silice (eluenti: etere petrolifero/acetato di etile). Le rese dei biarili variavano dall’86% al 99%.[4]
Homocoupling con Pd come catalizzatore
Generiche condizioni di reazione
Le reazioni di homocoupling catalizzate dal palladio sono emerse come una valida alternativa a quelle catalizzate da rame e nichel. Tuttavia, per una corretta implementazione delle reazioni di homocoupling catalizzate dal Pd, devono essere soddisfatte condizioni specifiche, tra cui:
L’uso di un agente riducente in grado di rigenerare la specie attiva Pd(0) dagli intermedi Pd(II) formatisi durante la reazione.
La presenza di un riducente è essenziale affinché la reazione possa procedere con quantità catalitiche di palladio. Per comprendere meglio l’importanza di questo riducente, è utile esaminare in dettaglio il meccanismo della reazione.[5]
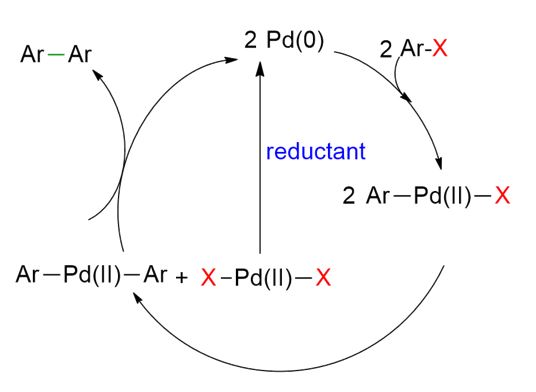
Come mostrato nella figura sopra, la reazione di homocoupling catalizzata dal palladio di alogenuri arilici inizia con l’addizione ossidativa di Ar–X al Pd(0), formando un intermedio Ar–Pd(II)–X. Successivamente si ritiene che due molecole di Ar–Pd(II)–X subiscano uno scambio di leganti, generando due nuove specie: Ar–Pd(II)–Ar e X–Pd(II)–X.
La specie Ar–Pd(II)–Ar subisce poi un’eliminazione riduttiva, producendo il biarile desiderato (Ar–Ar) e rigenerando il Pd(0), permettendo così la continuazione del ciclo catalitico. Al contrario, la specie X–Pd(II)–X non può rientrare nel ciclo catalitico a meno che non venga ridotta a Pd(0) da un agente riducente esterno.
Questo evidenzia perché un riducente è essenziale nelle reazioni di homocoupling catalizzate dal palladio: in sua assenza, una parte significativa del palladio rimane intrappolata come PdX₂, che è cataliticamente inattivo a meno che non venga riconvertito in Pd(0).
Gli agenti riducenti tipicamente utilizzati nelle reazioni di homocoupling catalizzate dal palladio sono riassunti nella tabella seguente.

Procedure tipiche con il Pd
La reazione seguente è compatibile con la maggior parte dei gruppi funzionali, ad eccezione degli alo-areni contenenti sostituenti come ciano, idrossi, gruppi carbossilici o amminici. Inoltre, questa reazione generalmente non procede con alo-areni sostituiti in posizione orto. Le reazioni collaterali più comuni includono la dealogenazione dei bromoareni (tipicamente 20–30%) e la transarilazione quando viene utilizzato AsPh₃.
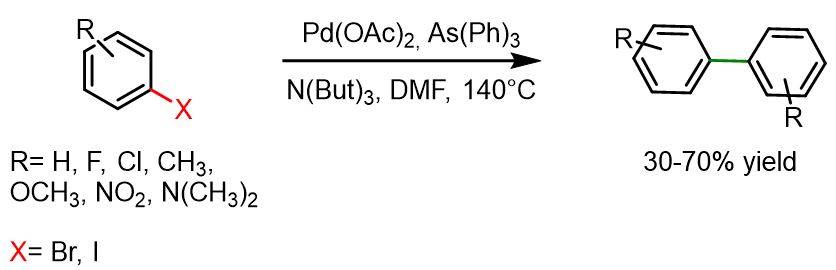
Procedura per bromoareni: Un pallone da 100 ml essiccato è stato riempito con aril alogenuro (100 mmol), DMF (40 ml), N(But)₃ (26 ml, 110 mmol), Pd(OAc)₂ (0,112 g, 0,5 mmol) e As(Ph)₃ (0,30 g, 1,0 mmol) sotto atmosfera di argon. La miscela di reazione è stata dapprima degassata e purgata con argon, quindi agitata a 140 °C per 24 ore. Successivamente, la miscela di reazione è stata versata in una soluzione acquosa di HCl al 10% (500 ml). I composti solidi precipitano dalla miscela e vengono quindi isolati per filtrazione, seguita da purificazione mediante ricristallizzazione da etanolo. I prodotti liquidi, invece, sono stati estratti con etere dietilico e purificati per distillazione.
Procedura per iodoareni: Gli iodoareni sono stati fatti reagire seguendo la stessa procedura utilizzata per i bromoareni, ma senza l’impiego della trifenilarsina.[6]
La reazione seguente, sviluppata dal gruppo di Lemaire, funziona bene con diversi tipi di aloareni — inclusi quelli con sostituenti in posizione meta, orto o para — così come con 2-alopiridine e 2- o 3-alochinoline.
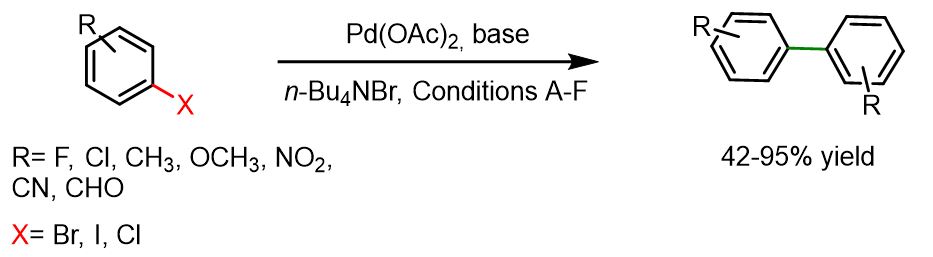
Una miscela composta da base (8 mmol), Pd(OAc)₂ (0,4 mmol, 5 mol%), Bu₄NBr (4 mmol) e aril alogenuro (8 mmol) in un solvente (1,25 mL) — toluene oppure una miscela di DMF/H₂O (0,90/0,35 mL) — è stata agitata sotto atmosfera di azoto per alcuni minuti a 105 °C (in toluene) o a 115 °C (in DMF). Quando necessario, è stato aggiunto isopropanolo (8 mmol), e la miscela di reazione è stata quindi riscaldata per un periodo variabile da 7 a 177 ore, a seconda del substrato utilizzato. Dopo il raffreddamento a temperatura ambiente, sono stati aggiunti acqua ed etere dietilico. Lo strato organico è stato lavato con acqua, anidrificato su MgSO₄, filtrato e concentrato a pressione ridotta. Il prodotto grezzo è stato purificato mediante TLC preparativa oppure ricristallizzazione.[7]
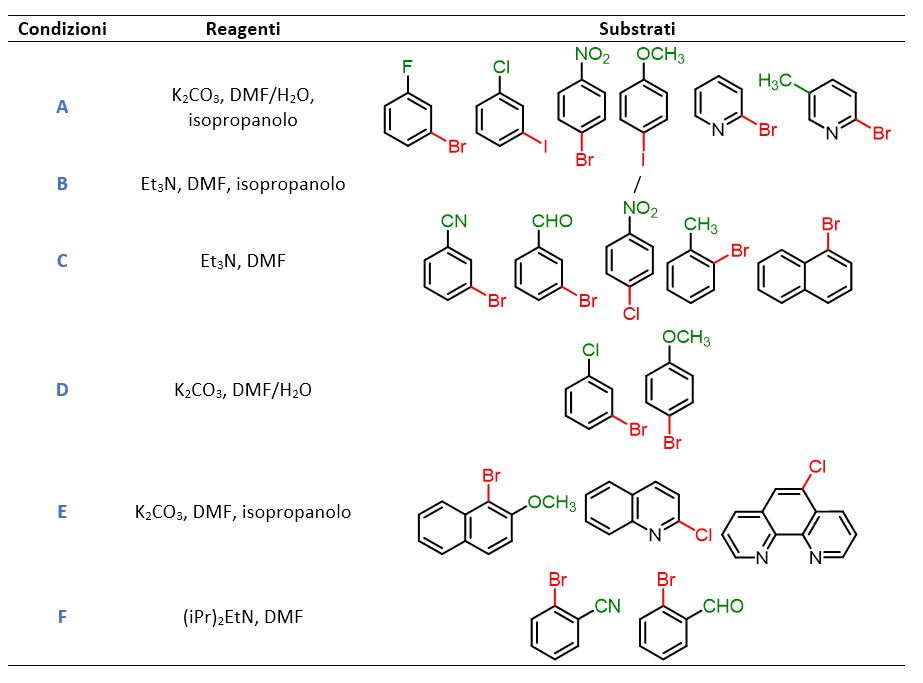
La tabella seguente riassume le Condizioni A–F insieme ai relativi substrati a cui è stato applicato ciascun insieme di condizioni.
Riferimenti
[1] Habgood, L. G.; Gregor, R. W. 7.1. A Solvent-Free Ullmann Coupling: Synthesis of 2,2′-Dinitrobiphenyl. In Comprehensive Organic Chemistry Experiments for the Laboratory Classroom; Afonso, C. A. M., Candeias, N. R., Simão, D. P., Trindade, A. F., Coelho, J. A. S., Tan, B., Franzén, R., Eds.; The Royal Society of Chemistry, 2016; pp 550–553. https://doi.org/10.1039/9781849739634-00550
[2] Degnan, A. P.; Meyers, A. I. Total Syntheses of (−)-Herbertenediol, (−)-Mastigophorene A, and (−)-Mastigophorene B. Combined Utility of Chiral Bicyclic Lactams and Chiral Aryl Oxazolines. J. Am. Chem. Soc. 1999, 121 (12), 2762–2769. https://doi.org/10.1021/ja984182x.
[3] Iyoda, M.; Otsuka, H.; Sato, K.; Nisato, N.; Oda, M. Homocoupling of Aryl Halides Using Nickel(II) Complex and Zinc in the Presence of Et4NI. An Efficient Method for the Synthesis of Biaryls and Bipyridines. Bulletin of the Chemical Society of Japan 1990, 63 (1), 80–87. https://doi.org/10.1246/bcsj.63.80.
[4] Jutand, A.; Mosleh, A. Palladium and Nickel Catalyzed Synthesis of Biaryls from Aryl Triflates in the Presence of Zinc Powder. Synlett 1993, 1993 (08), 568–570. https://doi.org/10.1055/s-1993-22531
[5] Kotora, M.; Takahashi, T. Palladium-Catalyzed Homocoupling of Organic Electrophiles or Organometals. In Handbook of Organopalladium Chemistry for Organic Synthesis; Negishi, E., Ed.; John Wiley & Sons, Inc.: New York, USA, 2002; pp 973–993. https://doi.org/10.1002/0471212466.ch40.
[6] Brenda, M.; Knebelkamp, A.; Greiner, A.; Heitz, W. Novel Palladium-Catalyzed Biaryl Synthesis with Haloarenes. Synlett 1991, 1991 (11), 809–810. https://doi.org/10.1055/s-1991-20885.
[7] Hassan, J.; Penalva, V.; Lavenot, L.; Gozzi, C.; Lemaire, M. Catalytic Alternative of the Ullmann Reaction. Tetrahedron 1998, 54 (45), 13793–13804. https://doi.org/10.1016/S0040-4020(98)00849-7
