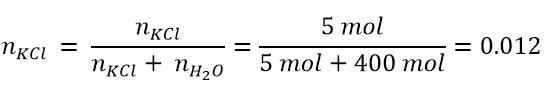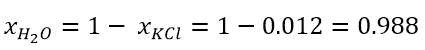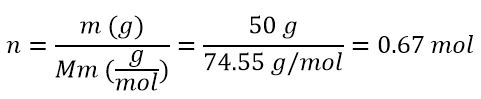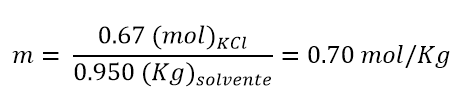Definizione
Cos’è una soluzione?
Una soluzione è una miscela OMOGENEA fatta da almeno due componenti: SOLUTO e SOLVENTE.
Le parole colorate sono molto importanti per capire la definizione di soluzione. Iniziamo dalla parola OMOGENEA. Per capire cosa voglia dire, consideriamo gli esempi seguenti:
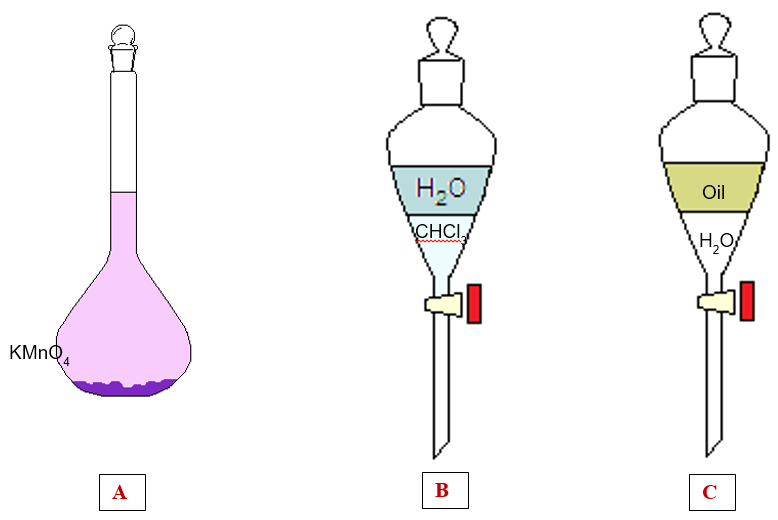
Delle tre situazioni di sopra, nessuna rappresenta una soluzione. Infatti la figura:
- A rappresenta una miscela di acqua e permanganato di potassio, KMnO4, solido viola. Questa però non è una soluzione perché non è omogenea, infatti parte del solido KMnO4, è rimasto depositato sul fondo. È in realtà una soluzione satura, concetto che tratteremo in un prossimo articolo.
- B raffigura due strati formati da due sostanze immiscibili: acqua e cloroformio. Anche questa non è una soluzione perché distinguiamo correttamente due strati che non si mescolano quindi non è una miscela omogenea.
- C è molto simile al caso precedente, solo che questa volta i due liquidi immiscibili sono olio e acqua. Anche questa non è una soluzione perché non omogenea.
Vediamo finalmente un caso di soluzione vera nell’immagine che segue:
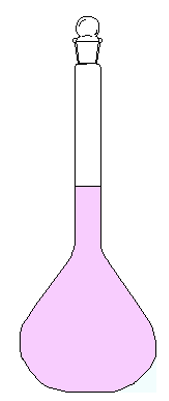
Questa è una SOLUZIONE di acqua e permanganato. Situazione molto simile al caso A, solo che questa volta di KMnO4 ne abbiamo messo molto meno, così che si solubilizzasse tutto in acqua. Pertanto la miscela è finalmente OMOGENEA perché non distinguiamo più il solvente (acqua) dal soluto (permangato di potassio), il quale è ‘’scomparso’’ in acqua.
Dunque abbiamo capito la prima parte della definizione, ma cosa vuol dire: fatta da almeno due componenti: SOLUTO e SOLVENTE? La frase si riferisce al fatto che una soluzione può essere composta anche da più soluti (es. NaCl e NaOH, entrambi solidi) sciolti in un solvente (es. acqua); tuttavia affinché si possa parlare di soluzione basta che ci siano almeno i due componenti principali SOLVENTE e SOLUTO.
Il solvente è generalmente la sostanza presente in eccesso, mentre il soluto è quella presente in difetto. Il soluto non deve per forza essere un solido, ma può essere anche un liquido o un gas miscibile con il solvente. Allo stesso modo il solvente può essere solido (come il ferro nell’acciaio), liquido o gassoso (come l’azoto nell’aria).
Tipi di soluzione
Le soluzioni si dividono in due grandi classi: soluzione non elettrolitica e soluzione elettrolitica.
- Una soluzione non elettrolitica è una soluzione che non è in grado di condurre l’elettricità. Un esempio è acqua e zucchero, dove le molecole di zucchero si solubilizzano in acqua originando molecole neutre (Figura 3, sinistra).
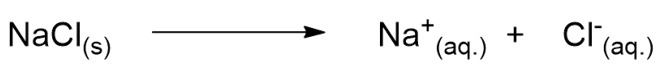
- Una soluzione elettrolitica è una soluzione in grado di condurre l’elettricità, questo perché in soluzione il soluto di divide in ioni, particelle cariche. Un esempio è NaCl in acqua. Tale sale non solo si solubilizza in acqua, ma si disgrega anche nei suoi ioni Na+ e Cl–, particelle cariche (Figura 3, destra).

Tuttavia la soluzione elettrolita si divide in due altre categorie (soluzione elettrolita forte e soluzione elettrolita debole), vediamo cosa sono.
- Si dice soluzione elettrolitica forte una soluzione in cui il soluto (l’elettrolita) si dissolve completamente nei suoi ioni. Un esempio è di nuovo NaCl in acqua; il cloruro di sodio, infatti, si disgrega completamente negli ioni Na+ e Cl– senza che nessun NaCl sia lasciato in soluzione.
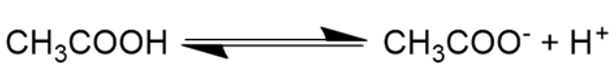
- Si dice soluzione elettrolita debole una soluzione in cui il soluto (l’elettrolita) non si dissolve completamente nei suoi ioni, ma in parte resta non disgregato. Un esempio è l’acido acetico, CH3COOH, che in parte si divide nei suoi ioni CH3COO– e H+, e in parte resta CH3COOH.
Composizione di una soluzione
La composizione di una soluzione si riferisce all’aspetto quantitativo di una soluzione, quindi al concetto di CONCENTRAZIONE. La concentrazione è un modo per definire quantitativamente la soluzione, esplicitando quanto solvente e quanto soluto c’è all’interno della stessa.
Ci sono vari modi di esprimere la concentrazione, a seconda delle grandezze fisiche usate. Le grandezze sono le seguenti:
– massa e volume, note come quantità fisiche;
– moli e equivalenti, note come quantità chimiche.
Quindi ci sono concentrazioni espresse solo con le unità fisiche, quelle espresse sono con le unità chimiche e infine quelle espresse con entrambe. Vediamole in dettaglio nel paragrafo che segue.
Concentrazioni in unità fisiche
Percentuale in massa
Usando la quantità fisica massa si definisce la prima delle concentrazioni che vedremo: la percentuale in massa. Tale concentrazione è espressa come segue:

Quindi è il rapporto tra la massa del soluto e quella della soluzione moltiplicato per 100. Essendo un rapporto tra quantità uguali (entrambe sono masse), tale concentrazione è indipendente dall’unità di misura usata. Per esempio potrei usare le masse espresse entrambe in chilogrammi o entrambe in grammi e il risultato non cambierebbe. L’importante è riportare entrambe le masse con la stessa unità di misura; per intenderci, sarebbe un errore scrivere la massa del soluto in grammi e quella della soluzione in chilogrammi.
Questo tipo di concentrazione in genere si usa quando il soluto è solido.
Svolgi questo esercizio breve per vedere se hai capito cos’è la percentuale in massa:
- Una soluzione è stata preparata, sciogliendo 20 g di NaCl in 100 g di acqua. Quale sarà la percentuale in massa di tale soluzione?
Percentuale in Volume
La percentuale in volume è molto simile alla concentrazione precedente, ma anziché usare le masse, usa i volumi.

Questo tipo di concentrazione in genere si usa quando il soluto è liquido.
Svolgi questo esercizio per vedere se hai capito:
- Abbiamo una soluzione preparata aggiungendo 2 ml di acido acetico in 100 ml di acqua. Calcolare la concentrazione in percentuale in volume.
Percentuale massa/volume
La percentuale massa su volume deriva dalla combinazione delle precedenti due ed è espressa come segue:

Questa modalità di esprimere la concentrazione è usata per lo più con le soluzioni fisiologiche.
È importante qui prestare più attenzione alle unità di misura, giacché bisogna mantenere la stessa proporzione. Per esempio se uso grammi (g) per la massa, devo usare millilitri (ml) per la soluzione; similmente se uso chilogrammi (kg) per la massa, devo usare litri (l) per il volume della soluzione. E così via.
Grammi su litro
La concentrazione grammi su litro è espressa come la massa di soluto (g) nel volume di soluzione in litri (l):

Tale concentrazione è in realtà una variante della precedente; infatti i rapporti tra le unità di misura sono cambiati: non più [g]/[ml] ma [g]/[l].
Concentrazione in unità chimiche
Frazione molare
La frazione molare si può esprimere per ogni componente della soluzione. Per esempio ci sarà una frazione molare del soluto e una del solvente. La frazione molare del soluto è il rapporto tra le moli del soluto e quelle della soluzione, secondo la:

Mentre la frazione molare del solvente sarà in modo simile espressa come:

Siccome le frazioni molari, come dice la stessa parola, sono frazioni, potrò ricavare la frazione molare del solvente, sapendo quella del soluto e viceversa come segue:

Se la soluzione contiene più di un soluto ci sarà una frazione molare per ogni componente della soluzione, quindi l’equazione generica sarebbe:
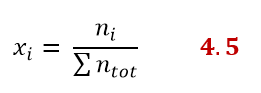
Svolgi il seguente esercizio per testare la tua comprensione:
- Supponiamo di avere una soluzione formata da 5 mol di KCl in 400 mol di acqua; quale sarà la frazione molare di KCl e quale del solvente?
Concentrazioni in unità fisiche e chimiche
Molalità
La molalità (m) è definita come il rapporto tra le moli del soluto e la massa del solvente espressa in chilogrammi:

This concentration differs from all the others because it is the only one to have a property of the solvent (the mass) in the denominator, while all the others always and only have a property of the solution in the denominator.
For this concentration, as for the others to follow, it is important to remember the units of measurement used to express moles and mass, which are respectively mol and kilograms. Variations of the aforementioned units, without maintaining the same proportion, will necessarily lead to an error and perhaps even a resounding exam’s rejection. So just remember to express molarity as [mol]/[Kg].
La molalità è una concentrazione che non varia con la temperatura, quindi può essere usata in tutti quegli esperimenti dove le soluzioni sono soggette a sbalzi termici.
Svolgi questo esercizio per testare la tua comprensione:
- Si hanno 950 g di acqua in cui vengono solubilizzati 50 g di KCl, quale sarà la molalità della soluzione?
Molarità
Anche se il suo nome è molto simile alla concentrazione precedente, in realtà la molarità è espressa in modo diverso. È infatti il rapporto tra le moli del soluto e il volume della soluzione espresso in litri. Le unità di misura sono dunque [mol]/[L].

Per capire meglio la molarità immaginiamo di dover preparare una soluzione 1M di NaHCO3 in acqua. Come procedere?
In realtà 1 M vuol dire 1 mol di soluto, nel nostro caso NaHCO3, in un litro di soluzione. Quindi basterà pesare una mole di NaHCO3, dopo aver calcolato i grammi corrispondenti a tale mole, usando la massa molare di tale sostanza. Il risultato è:
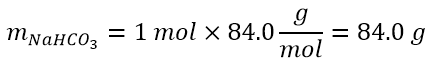
Dunque 84.0 g andranno inseriti in un matraccio tarato, che è uno strumento adatto a preparare soluzioni molari e che reca una tacca per indicare un volume preciso (vedi immagine in basso). Quindi nel nostro esempio prenderemo un matraccio da 1L, così da essere sicuri di avere un litro al raggiungimento della tacca. Dopo aver inserito in nostro soluto, inseriamo parte del solvente, ma senza raggiungere ancora la tacca. Agitiamo un po’ il matraccio per solubilizzare tutto il soluto e una volta che la soluzione è limpida e senza residui di solido, possiamo aggiungere il resto del solvente fino al raggiungimento della tacca.

La ragione per cui si porta a volume solo dopo aver già solubilizzato il soluto, è dovuta al fatto che la solubilizzazione di un soluto in un solvente comporta un aumento o una diminuzione di volume, dipendentemente dal tipo di interazione solvente/soluto. Quindi, tornando al nostro esempio, se aggiungessimo direttamente 1L di acqua e poi inserissimo il soluto, al momento della solubilizzazione il volume potrebbe aumentare e la soluzione non sarebbe precisamente di 1L.
Normalità
La normalità è molto simile alla molarità, ma invece di usare le moli usa gli equivalenti. È espressa come:

C’è una relazione che lega molarità e normalità ed è la seguente:

Dove v è un numero intero, quindi v = 1,2,3,4…. Questo implica che la molarità e la normalità sono uguali se v =1, altrimenti la normalità è in genere più grande. Il numero v si riferisce al numero di cariche (per reazioni tra ioni) o al numero di elettroni (per reazioni redox) della reazione bilanciata.
Per capire meglio facciamo un esempio. Prendiamo la dissociazione dell’acido cloridrico in acqua, la reazione bilanciata è la seguente:

v in questo caso è 1 perché a sinistra dell’equazione si è sviluppata una carica positiva (+1) e una negativa (-1). In questo caso N = M.
Invece se consideriamo la dissociazione del solfato di ferro, la reazione bilanciata è la seguente:
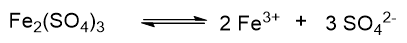
qui v = 6, perché a sinistra ci sono due ioni ferro carichi 3+, per un totale di 6+ e tre ioni solfato carichi 2-, per un totale di 6-. In questo caso N = M × 6.
Una volta chiarito cos’è v, possiamo finalmente definire gli equivalenti come il rapporto tra massa e massa equivalente. La massa equivalente si ricava dividendo la massa molare per v:

Se questa equazione non ti piace, ce n’è un’altra che comunque si ricava dalla precedente, ma più semplice da ricordare. Gli equivalenti possono essere calcolati anche come il prodotto tra moli e v:
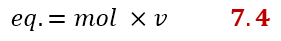
Facciamo un esempio per calcolare la normalità. Supponiamo di avere 1 g di Fe2(SO4)3 e di scioglierlo in un matraccio tarato da 1L. Dopo aver portato a volume, ci chiediamo quale sia la normalità di tale soluzione. Sappiamo già dalla reazione scritta precedentemente che v = 6, quindi possiamo facilmente calcolare gli equivalenti come segue:

Siccome la normalità è il rapporto tra equivalenti e volume della soluzione e siccome il volume finale è 1 L, allora 0.015 è anche il valore della normalità.
Questa lezione

Soluzioni & Concentrazioni
€
1.50
Scarica pdf (non modificabile)

Soluzioni & Concentrazioni
€
2.50
Scarica docx (modificabile)