Introduzione
In questo articolo parliamo di Syngas. Vedremo cos’è il syngas, come viene sintetizzato in industria e alcune delle sue trasformazioni.
Definizione
Il syngas, noto anche come gas di sintesi, è composto principalmente da CO, H2 ma anche N2, CH4, CO2.
Ad ogni modo si parla di syngas se la miscela contiene almeno CO e H2.
Produzione
Il syngas è prodotto per il:
- 54% da carbone
- 30% da petrolio
- 3% da gas naturale
In teoria lo si può produrre da qualsiasi fonte carboniosa con percentuale variabile di C e H. In particolare si fa reagire l’idrocarburo con una fonte di ossigeno; a seconda della fonte usata, diversi processi sono possibili:
- Steam reforming dove si usa acqua come fonte di ossigeno;
- Ossidazione parziale che usa ossigeno;
- Dry reforming che usa anidride carbonica;
- Combinazione di steam reforming e ossidazione, che usano acqua e ossigeno.
Vediamo questi 4 processi singolarmente.

Vuoi leggere questo articolo comodamente offline? Ti piacerebbe stamparlo? O ancora ti serve modificarlo per un tuo uso personale? Scarica l’articolo in formato pdf o docx qui.
Steam reforming
Il termine steam reforming indica una reazione in cui un idrocarburo reagisce con acqua in presenza di un catalizzatore.
Siccome la reazione avviene in presenza di un catalizzatore, occorre eliminare eventuali tracce di composti solforati presenti nel materiale di partenza per la sintesi. Dopo la desolforazione si può operare lo steam reforming. I passaggi sono riassunti nello schema seguente prendendo il metano come materiale di partenza.
Nel caso l’idrocarburo sia il metano, la reazione dello steam reforming è la seguente

La reazione tra metano e vapore di acqua è endotermica e reversibile.
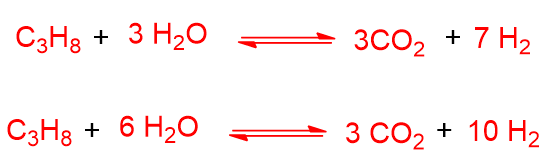
Invece del metano, nello steam reforming si possono usare anche propano o nafta. Come si può vedere in basso, il propano dà la reazione di steam reforming con rapporti più alti di CO/H2 rispetto al metano, specialmente se si aumenta la quantità di vapore (seconda reazione in basso):
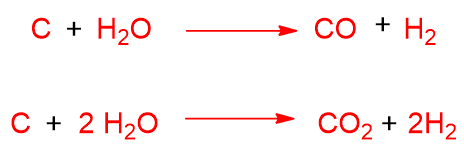
Se prendiamo come esempio lo steam reforming del metano, una reazione indesiderata che potrebbe accadere durante tale processo è la decomposizione del metano a formare coke. Questa è una sostanza carboniosa con alto rapporto C/H che potrebbe bloccare la conversione nel reattore per intasamento dei tubi dove fluisce il catalizzatore. La decomposizione del metano avviene secondo la:

Un’altra reazione indesiderata è la disproporzione del CO, detta reazione di Boudouard.

Per minimizzare la formazione di coke si può abbassare la pressione del metano e si mette un eccesso di acqua rispetto al metano (3.5/1 H2O/CH4) per far avvenire la seguente reazione:
Dalla reazione di sopra si vede come il rapporto CO2/CO aumenta con l’aumento della quantità di acqua. Inoltre se si aumenta la quantità di acqua, si può far avvenire anche la seguente reazione.

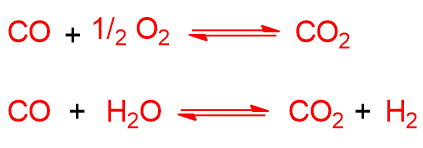
detta Water-gas o shift reaction, una reazione leggermente esotermica che consente di trasformare CO in CO2 attraverso l’uso di H2O e ossidi di ferro come catalizzatore. Questa reazione aumenta il rapporto H2/CO del syngas, quindi permette di modificare il syngas a seconda delle quantità relative dei due gas che servono. Per esempio, se si deve sintetizzare l’ammoniaca o idroformilare allora si avrà bisogno di un rapporto alto H2/CO. La reazione può anche tornare indietro se si aggiunge CO2 e dare di nuovo CO, da qui il nome shift reaction.
Al fine di avere dei reattori più compatti, le industrie di steam reforming optano per reattori che operano a pressioni alte, nonostante questo sfavorisca termodinamicamente la conversione dell’idrocarburo in syngas. Infatti, più si aumenta la pressione, più, per il principio di Le Châtelier, l’equilibrio della reazione di steam reforming si sposta verso i reagenti, dove il numero di moli coinvolte è inferiore in modo da minimizzare l’incremento di pressione. Tuttavia per rendere possibile questa esigenza tecnica dell’industria, occorre aumentare la temperatura per spostare nuovamente l’equilibrio verso i prodotti, dato che la reazione di steam reforming è endotermica.
In conclusione per avere un buon risultato dallo steam reforming si opera in questo regime: alta pressione, alta temperatura, alti rapporti H2O/CH4 o più in generale H2O/idrocarburo.
Dry reforming
Tale reforming è molto simile a quello precedente, ma invece di usare l’acqua come fonte di ossidazione, usa il diossido di carbonio. Si veda la reazione seguente per il metano:

Ossidazione parziale
Il syngas può essere prodotto anche attraverso ossidazione parziale a partire da vari substrati come carbone, metano, nafta. Tale metodo è scelto per materie prime di partenza che sono idrocarburi liquidi. Dopo aver operato l’ossidazione parziale si deve rimuovere la fuliggine (SOOT) e poi di deve desolforare prima di poter avere il syngas. Si veda lo schema sottostante, che riassume le varie fasi del processo.

Le reazioni di ossidazione parziale sono esotermiche e irreversibili, anche se meno esotermiche dell’ossidazione completa degli idrocarburi.
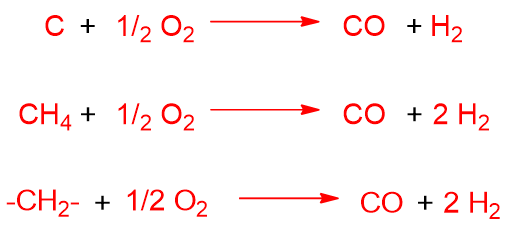
Anche in questo processo possono avvenire delle reazioni indesiderate come la completa ossidazione, la formazione di CO2 dal CO e la formazione di acqua da H2 e O2.
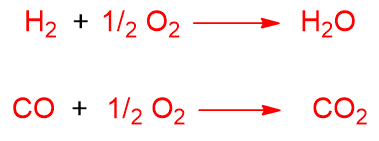
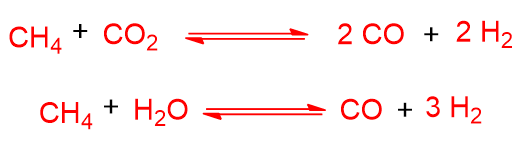
Il calore prodotto dall’ossidazione parziale può promuovere proprio le reazioni di steam reforming e dry reforming, viste prima. Tali reazioni non fanno altro che arricchire il gas di sintesi. Rivediamole nel caso del metano:
Nel caso dell’ossidazione parziale si deve usare O2 puro, questo significa che l’impianto deve produrre l’ossigeno puro (tramite tecniche come la liquefazione dell’aria, l’adsorbimento a pressione oscillante o l’adsorbimento a temperatura oscillante) oppure deve comprarlo da fornitori terzi.
Combinazione di steam reforming e ossidazione parziale
Si può combinare lo steam reforming con l’ossidazione parziale, aggiungendo O2 al vapore. Questa combinazione offre il vantaggio di usare una reazione esotermica (l’ossidazione parziale) insieme a una endotermica (lo steam reforming)e quindi di operare senza riscaldamento esterno: processo autotermico.
Gassificazione
La gassificazione è operata con materiale di partenza come carbone. Dopo la gassificazione di deve rimuovere il particolato prima di poter isolare il syngas. Ecco uno schema dei processi coinvolti:
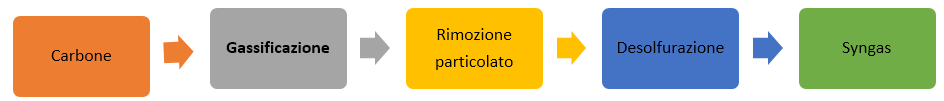
Tale processo si differenzia dallo steam reforming perché il suo principale scopo è di trasformare il carbone in gas e non di produrre il syngas. Quindi lo steam reforming è fatto appositamente per produrre syngas da usare per scopi chimici, mentre la gassificazione è fatta per ottenere gas da cui si può ricavare energia.
Il syngas prodotto in questo modo non contiene solo CO e H2 ma anche altri componenti.
Il carbone è fatto reagire con H2O e O2 o aria. Se schematizziamo il carbone con C, le reazioni endotermiche che avvengono sono le seguenti:
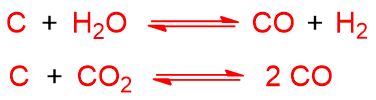
Mentre le reazioni esotermiche sono:
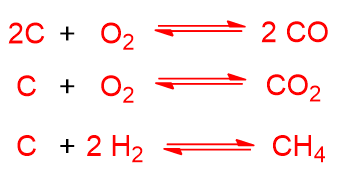
Possono avvenire anche le seguenti reazioni esotermiche ma in fase omogenea:
Da queste ultime reazioni si spiega la presenza di CO2 nel reattore. Ovviamente data la materia prima complessa altre reazioni sono possibili, tuttavia quelle elencate sono le principali.
Durante la gassificazione si formano vari prodotti divisibili in due macro-categorie: un residuo solido e uno gassoso.
Infatti, nella fase di riscaldamento del carbone si verifica la decomposizione termica delle molecole organiche con formazione di radicali. Alcuni di questi radicali possono condensare o polimerizzare dando vita al residuo solido del processo di gassificazione noto come char. I composti più volatili invece fanno parte della fase gassosa e possono essere il syngas, formato con le reazioni descritte sopra, o molecole organiche aromatiche volatili.
La fase gassosa dunque contiene H2O, CO2, CO, H2, CH4 e composti aromatici volatili.
Se la gassificazione viene fatta in regime autotermico, ossia senza applicazione di calore esterno, allora si aggiunge ossigeno all’alimentazione. La conseguenza della maggiore presenza di ossigeno è la formazione di maggiori quantità di CO e CO2 rispetto a H2 e CH4.
Trasformazione del syngas
Il syngas viene usato come:
- Substrato chimico per sintesi di NH3, idrocarburi (Processo Fisher-Tropsch), metanolo, aldeidi e acidi carbossilici.
- Vettore energetico, lo si trasforma in benzina nei paesi che non possono lavorare con miscele di Nafta e Gasolio
Sintesi dell’ammoniaca
L’ammoniaca dal syngas è sintetizzata usando il processo Haber, secondo la reazione seguente:

La reazione avviene solo in presenza del catalizzatore a base di ferro, altrimenti la stabilità dell’azoto è talmente alta che la reazione non avverrebbe.
Tale reazione è esotermica, perciò è favorita a temperature basse. La pressione se alta favorisce lo spostamento dell’equilibrio a destra.
Per la produzione di ammoniaca si usa il gas naturale perché è quello che produce syngas con più alta concentrazione di idrogeno.
L’impianto di produzione dell’ammoniaca dal gas naturale prevede le seguenti tappe:
- Desolforazione del gas naturale;
- Primo steam reforming del gas naturale;
- Secondo steam reforming con l’aggiunta di aria e altro metano; l’aggiunta di aria permette la formazione di CO2 da O2 e CO e consente di effetture la reazione di shift. Questo passaggio è autotermico perché per via della presenza di O2 avviene anche la combustione parziale che è esotermica. Il calore creato è usato per le reazioni endotermiche del reforming;
- Reazione di shift operata a temperatura bassa e in presenza di catalizzatore a base di rame;
- Metanazione di CO e CO2 residui per trasformarli in metano che non è dannoso per la reazione di Haber; mentre gli ossidi del carbonio vanno eliminati perché altrimenti disattivano il catalizzatore. La metanazione è la reazione tra CO o CO2 e H2 a dare CH4 e H2O;
- Condensatore delle impurità;
- Gas (H2 e N2) mandato al reattore per la produzione di ammoniaca.
Quindi l’ammoniaca si ottiene dallo steam reforming aggiungendo aria, che contiene N2, alla miscela CO e H2, ottenute dal primo steam reforming.
L’aria, però, che contiene anche O2, permette di eliminare CO secondo la reazione:

La CO2 può essere poi rimossa con etanolammina e strippaggio.
Sintesi del metanolo
Il syngas può essere usato per produrre metanolo secondo le reazioni:
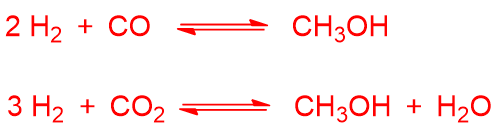
L’anidride carbonica può derivare dalla reazione di coupling ossia reazione tra monossido di carbonio e acqua se presente (detta anche reazione di water-gas o shift reaction, vista precedentemente):

Tutte queste reazioni sono esotermiche. Tuttavia la conversione di CO a metanolo è favorita a temperature basse e a pressioni alte, mentre la conversione dell’anidride carbonica a metanolo è favorita a temperature alte, per via della reazione di water-gas che entra in gioco. Per favorire la reazione si dovrebbe allora usare pressione alta che favorisce entrambe le conversioni.
Ad oggi però sono stati scoperti catalizzatori a base di rame in grado di operare a basse pressioni e basse temperature. Tuttavia, affinché i catalizzatori funzionino, occorre un syngas privo di contaminazioni di zolfo.
Il catalizzatore deve anche permettere alta selettività verso la formazione del metanolo dato che altri prodotti sarebbero possibili, come metano, etano, propano e etanolo.
A tal fine il miglior catalizzatore oggi in uso è KATALCO 55-1, che consiste in ossido di zinco, rame e allumina, dove il rame è il catalizzatore attivo. La selettività eccede il 99%.
Il syngas che si usa per la formazione di metanolo è quello proveniente dallo steam reforming della nafta, perché alti rapporti H2/CO sono necessari per avere il metanolo. Il rapporto favorevole è almeno 2/1 H2/CO. Se si usasse il syngas proveniente dal gas naturale si avrebbe un rapporto più alto H2/CO e questo non sarebbe conveniente per l’impianto, dato che poi bisognerebbe trattare l’eccesso di idrogeno. Se il syngas, invece, ha un valore più basso di 2/1 H2/CO si formerebbero più sottoprodotti come alcoli a catena più lunga. Dunque il rapporto ideale è 2/1.
Se non si ha a disposizione un tale syngas si può:
- Aggiungere CO al processo, in caso di syngas troppo ricco di idrogeno;
- Aggiungere un secondo reforming alimentato a ossigeno dopo lo steam reforming a acqua, per aumentare il contenuto di CO.
- Eliminare l’idrogeno in eccesso dopo la reazione
Sintesi di Fischer-Tropsch
Questo processo converte il syngas in idrocarburi con lunghezza di catena nell’intervallo C2-C19.
Le reazioni tipiche per dare alcani o alcheni sono:

Tali reazioni sono però accompagnate da possibili reazioni indesiderate come:
- la reazione di shift, che però può essere usata per abbassare la quantità di CO, il quale potrebbe non essere compatibile con certi catalizzatori per la reazione di Fischer-Tropsch (vedi schema 20);
- formazione di alcoli secondo la:

dal punto di vista termodinamico la formazione di alcoli rispetto agli alcani è favorita.
- formazione di coke a temperature alte; questa reazione è irreversibile e non voluta perché compromette il reattore. Per evitarla occorre tenere le temperature non troppo alte.

La lunghezza della catena ottenuta nel processo di Fischer-Tropsch dipende dal rapporto CO/H2, dalla temperatura e dal catalizzatore usato. A temperature più alte sono favorite le catene corte. Per quanto riguarda, invece, l’influenza del catalizzatore, tipicamente per avere:
- Catene lunghe si usano catalizzatori al Co. Tali catalizzatori sono attivi tra i 200-240 °C con rapporti di syngas H2/CO 2.15/1. Occorrono rapporti più alti tra idrogeno e monossido di carbonio perché questo catalizzatore non fa la reazione di shift, che consuma CO e produce idrogeno. Siccome il cobalto è più costoso si cerca di aumentare la sua area superficiale usando dei supporti come Al2O3, silice etc. Questo catalizzatore essendo molto attivo porta con molta probabilità alla formazione di cere. Per portare le cere a un peso molecolare più basso si opera l’idrocracking (a temperatura alta e in presenza di idrogeno le catene si riducono in dimensione).
- Catene corte si usano catalizzatori al Fe. Questo catalizzatore è attivo tra i 300-350 °C con rapporti di syngas H2/CO 1.7/1. Rispetto al Co è superiore per syngas ricco di CO dato che catalizza anche la reazione di shift. I catalizzatori al Fe restituiscono per lo più catene corte lineari sia alcani sia olefine; per aumentare un po’ la resa in catene più lunghe, si può aggiungere un additivo alcalino, come K2O.
Dunque, i catalizzatori più usati nella sintesi di Fischer-Tropsch sono cobalto, ferro, rutenio perché hanno orbitali d semipieni e riescono bene a propagare la catena. Altri catalizzatori come il nickel pur essendo molto reattivo restituisce principalmente metano, ragion per cui non è usato.
È bene evitare formazione di carbonio durante la reazione perché questo disattiverebbe il catalizzatore specialmente quelli a base di ferro, mentre il Co è più sensibile ai composti solforati che possono essere presenti nella materia prima usata per fare il syngas.
Questo articolo

Syngas
€
1.50
Scarica pdf (non modificabile)

Syngas
€
2.50
Scarica docx (modificabile)

