La pubblicazione da non perdere
Le importanti pubblicazioni che un chimico deve sapere. Oggi abbiamo scelto:
The Grignard reaction – Unravelling a chemical puzzle
Peltzer, R. M., Gauss, J., Eisenstein, O., & Cascella, M. (2020). Journal of the American Chemical Society, 142(6), 2984–2994.
‘’Più di 100 anni dopo la sua scoperta, il meccanismo della reazione di Grignard rimane irrisolto. Il puzzle della reazione di Grignard si sta finalmente componendo, con potenziali impatti sulla chimica correlata’’.

INTRODUZIONE
Nel nostro articolo precedente, abbiamo descritto la scoperta rivoluzionaria dei reattivi di organomagnesio, pionieristica opera dell’uomo che odiava la chimica: Victor Grignard. Tuttavia, anche dopo un secolo da questa scoperta, il meccanismo della reazione di Grignard è rimasto un enigma per i chimici di tutto il mondo.
Recentemente, il gruppo di Cascella ha fatto luce su questo argomento oscuro e antico, fornendo nuove intuizioni alla comunità scientifica grazie alla chimica computazionale. [1]
In questo articolo, intendiamo chiarire definitivamente il meccanismo della reazione di Grignard basandoci sui dati più recenti della letteratura.
STATO DELL’ ARTE
‘’Victor Grignard. Photograph by GL Arlomer, Lyons’’ by Wellcome Collection [CC BY 4.0] via https://www.lookandlearn.com…
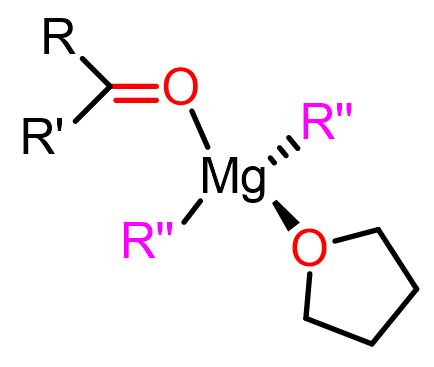
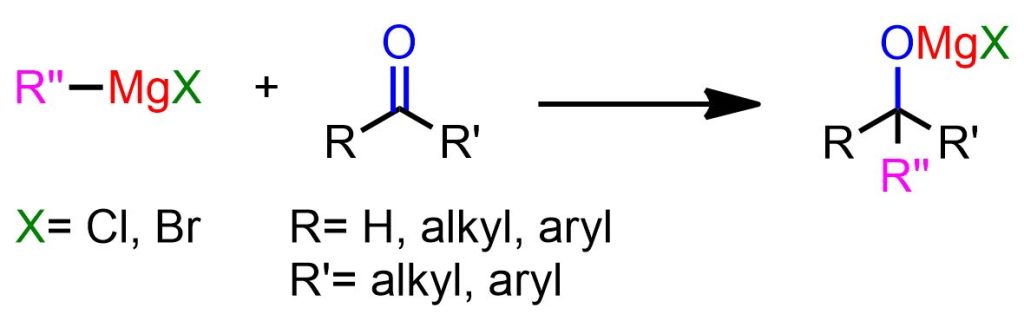
Per reazione di Grignard si intende la reazione di composti di organomagnesio, RMgX, con un elettrofilo per formare nuovi legami C-C. In questo articolo, tratteremo nello specifico la reazione di RMgX con chetoni e aldeidi (Figura 1) per ottenere alcoli sostituiti.
Finora, i chimici hanno suggerito due meccanismi:
Il meccanismo radicalico (Figura 2a);
L’ addizione nucleofila (Figura 2b).
Nella letteratura precedente, il substrato elettrofilo sembrava essere il fattore discriminante tra i due meccanismi. In particolare, l’addizione nucleofila è stata confermata per le aldeidi alifatiche, mentre il meccanismo radicalico è stato osservato con substrati che possiedono un basso potenziale di riduzione, come le aldeidi aromatiche e i chetoni.[2]
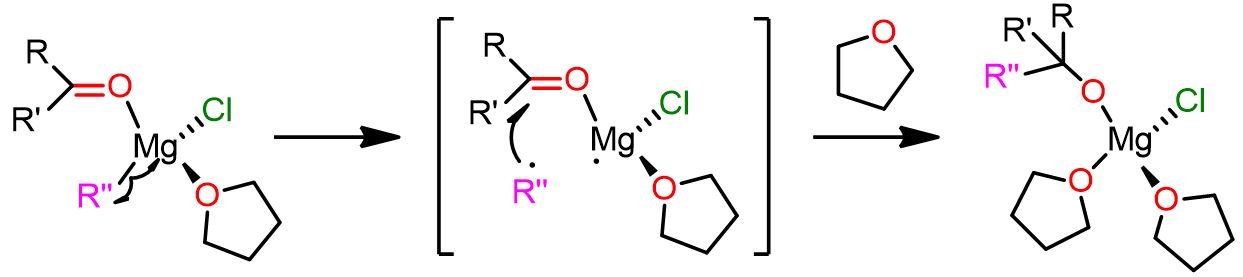
Figura 2a- Possibile meccanismo radicalico: rottura omolitica del legame Mg-C, seguita dalla ricombinazione dei radicali.

Figura 2b- Possibile meccanismo nucleofilo: rottura eterolitica del legame Mg-C, seguita da attacco nucleofilo di R– al carbonile.
La difficoltà nel razionalizzare il meccanismo deriva da due fattori principali:
– Le evidenze empiriche di due tipi di meccanismi: radicalico o nucleofilo;
– L’esistenza in soluzione di complessi di organomagnesio mononucleari, dinucleari,e polinucleari .
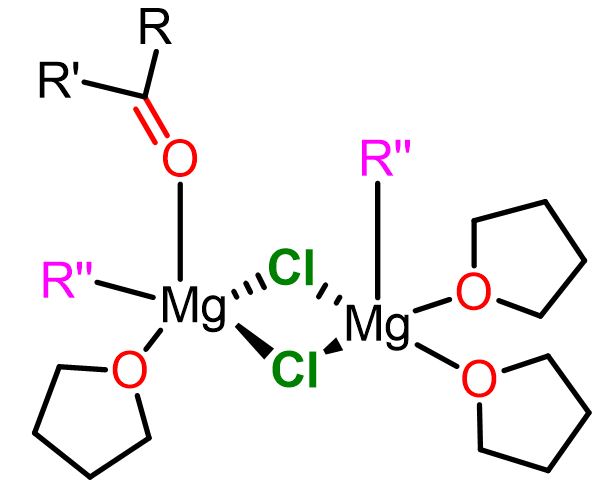
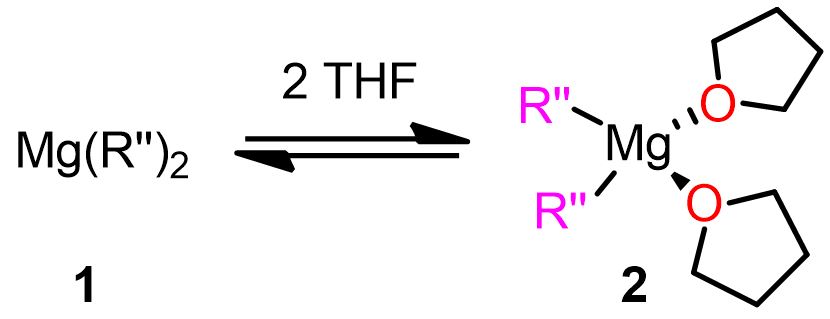
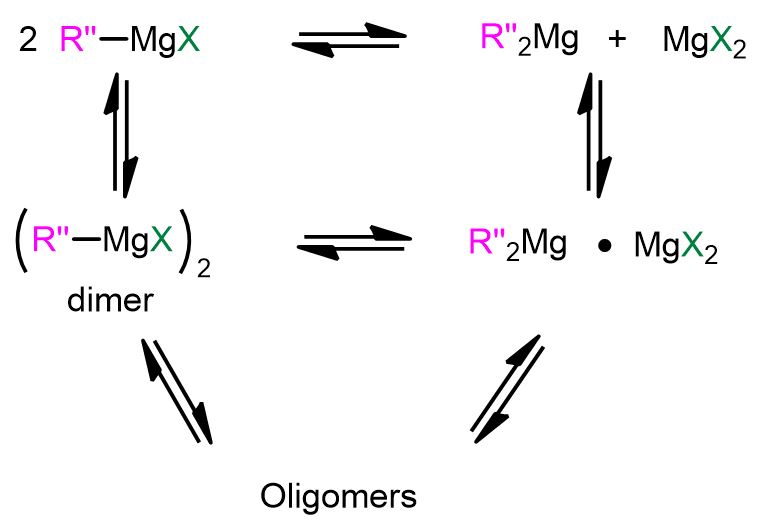
Riguardo all’ultimo punto, è noto che RMgX esiste in soluzione in una varietà di forme, a seconda del solvente e della concentrazione. Tuttavia, le due specie chimiche più famose sono quelle coinvolte nel cosiddetto equilibrio di Schlenk (Figura 3), dove i composti monoalchilici di magnesio (RMgX) si interconvertono nei composti dialchilici (MgR2) attraverso la formazione di dimeri e oligomeri. Questi complessi di Mg possono svolgere un ruolo nel meccanismo della reazione di Grignard.[3]
SVELATO IL MECCANISMO DELLA REAZIONE DI GRIGNARD
Tra le informazioni conosciute e confuse sul meccanismo di Grignard, nel 2020 il gruppo di Cascella ha finalmente ricomposto il puzzle e presentato un meccanismo convincente che spiega tutti i risultati sperimentali precedenti. Attraverso la chimica computazionale, hanno rivelato i percorsi più probabili per questa reazione.
Il meccanismo della reazione di Grignard può avvenire sia con l’addizione nucleofila che con il percorso radicalico. Tuttavia, il meccanismo preferito dipende dalla natura del substrato elettrofilico:
I substrati con potenziale di riduzione più basso e sostituenti ingombranti seguono il meccanismo radicalico.
I substrati con gruppi alchilici attaccati al gruppo carbonilico o quelli con sostituenti meno ingombranti generalmente subiscono un’addizione nucleofila.
Nelle sezioni successive di questo articolo, copriremo entrambi i meccanismi in maggior dettaglio.
Addizione nucleofila
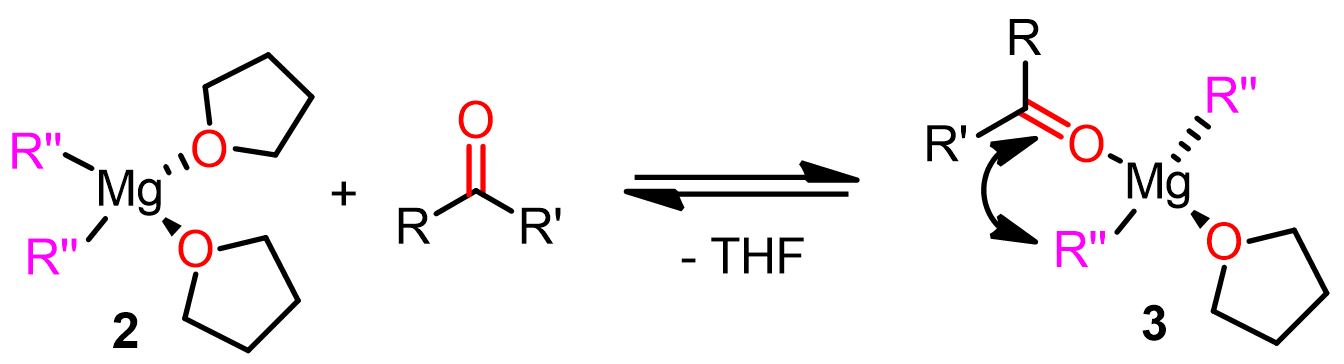
Il team di Cascella ha individuato due complessi di magnesio come reattivi principali del meccanismo nucleofilo. Uno é un complesso mononucleare dove il substrato carbonilico (O=CR2) e il nucleofilo alchilico (R”) sono in posizione cis tra loro (posizione geminale). Il secondo complesso reattivo è un complesso dinucleare dove il substrato elettrofilo e il nucleofilo alchilico sono legati a due atomi di magnesio diversi (posizione vicinale). I due complessi in questione sono raffigurati in basso.
Entrambi questi complessi sono reattivi e contribuiscono alla formazione del prodotto finale. La predominanza di un complesso rispetto all’altro dipende dall’equilibrio di Schlenk di quel particolare reagente di Grignard.
Ora, esploriamo il percorso nucleofilo con entrambi questi complessi.
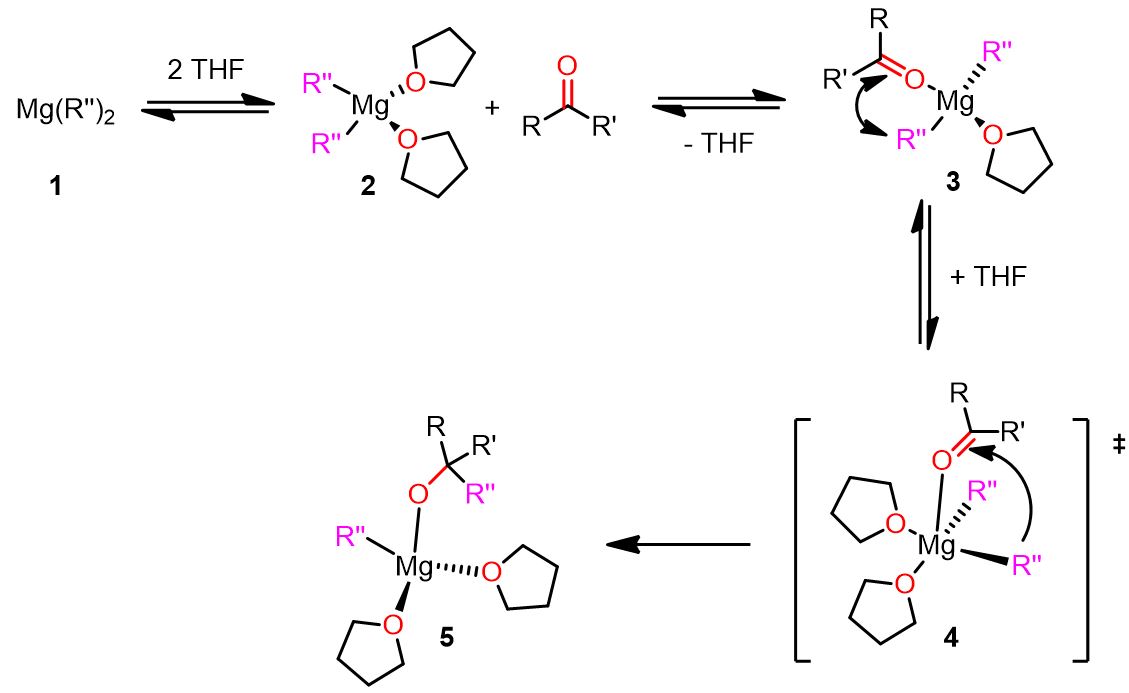
Meccanismo polare con il complesso geminale mononucleare
Il meccanismo geminale è stato nominato dal team di Cascella per fare riferimento al complesso reattivo mononucleare geminale di organomagnesio, che è una delle principali specie chimiche formate durante questo percorso.
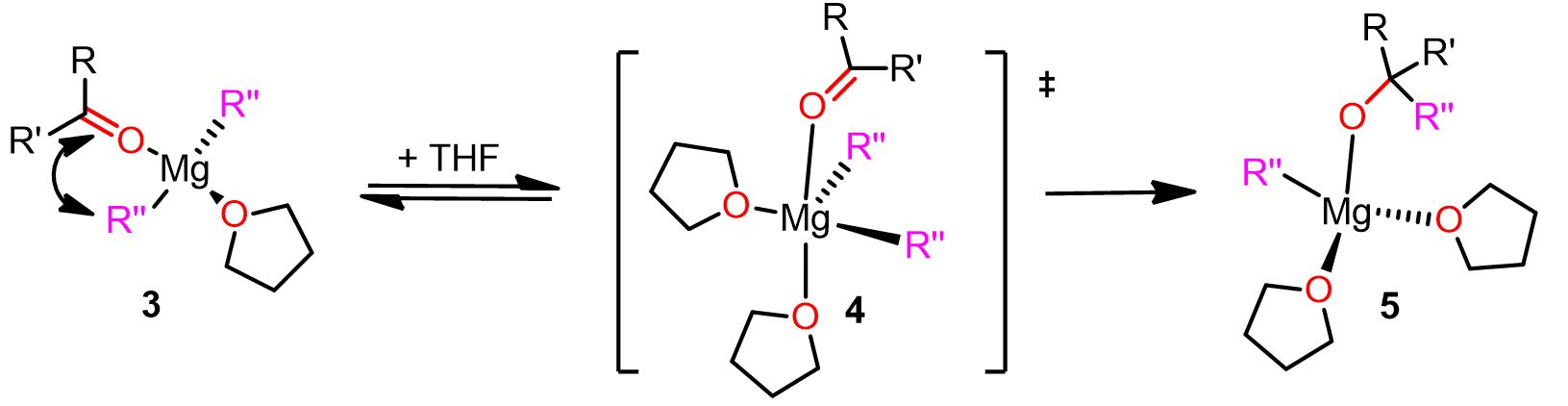
Il meccanismo è descritto in basso. Clicca su ogni step per vedere il meccanismo completo.
Come puoi vedere, nel meccanismo descritto sopra, le molecole di solvente svolgono un ruolo fondamentale nella reazione. Ad esempio, nell’ultimo passaggio, la molecola di THF entrante costringe il composto carbonilico a occupare la posizione apicale e favorisce la rottura del legame Mg-R” donando densità elettronica al Mg.
Pertanto, la scelta del solvente giusto per la reazione di Grignard può essere importante per il successo della reazione. I solventi donatori di elettroni, infatti, rendono il magnesio più reattivo e il nucleofilo un miglior gruppo uscente.
Viene di seguito fornita un’illustrazione completa del meccanismo geminale.
Meccanismo polare con il complesso dinucleare vicinale
Questo secondo meccanismo competitivo per la reazione di Grignard coinvolge un complesso dinucleare come intermedio reattivo. In questo complesso, le due specie reagenti (R” e il composto carbonilico) sono in posizioni apicali e legate a due diversi atomi di Mg (6 nella Figura 5). Il complesso è anche altamente solvatato e questo fa sì che l’elettrofilo e il nucleofilo siano più vicini tra loro.
Questo secondo meccanismo è rappresentato nella figura seguente.
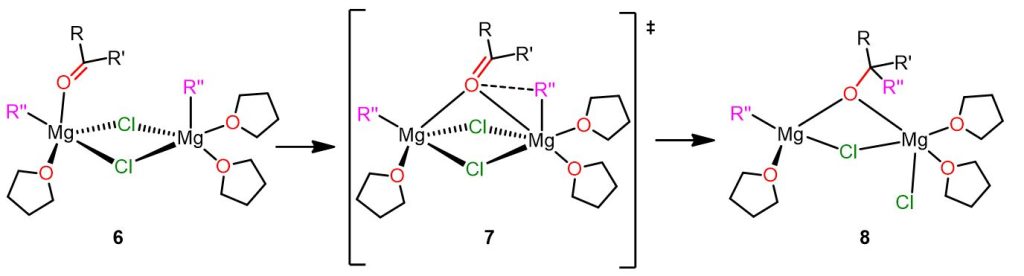
In questo meccanismo, la specie 6 si forma durante l’equilibrio di Schlenk ed è una delle specie più abbondanti. Inoltre, questo complesso dinucleare mostra anche una minore energia di attivazione rispetto al precedente complesso mononucleare 3.
Il complesso 6 subisce un riarrangiamento che porta allo stato di transizione 7, dove il substrato carbonilico elettrofilo si lega ai due atomi di Mg. In questo stato di transizione, il primo Mg è pentacoordinato, mentre il secondo è ottaedrico. Ora il gruppo carbonilico è più vicino al gruppo alchilico nucleofilo R”, e si forma un legame tra di loro. Inoltre, l’atomo di Cl, posizionato di fronte al composto carbonilico, rompe il suo legame con il primo atomo di Mg e diventa un ligando terminale.
Nel prodotto 8, il primo atomo di Mg è tetracoordinato, mentre il secondo è pentacoordinato. Come puoi vedere, il prodotto è a ponte tra i due atomi di Mg.
Il meccanismo radicalico
L’altro meccanismo competitivo della reazione di Grignard è quello radicalico. Tuttavia, la rottura omolitica del legame R-Mg ha un’energia di dissociazione del legame elevata; quindi il radicale alchilico non può essere formato in una soluzione pura dei reagenti di Grignard.
La formazione di radicali, e quindi il meccanismo radicalico, è possibile solo quando il substrato elettrofilo ha un basso potenziale di riduzione. Ciò suggerisce che sia il substrato a promuovere il meccanismo radicalico.
Prima di capire perché i substrati con basso potenziale di riduzione possano promuovere il meccanismo radicalico, vediamo tale meccaniso nell’immagine qui sotto.
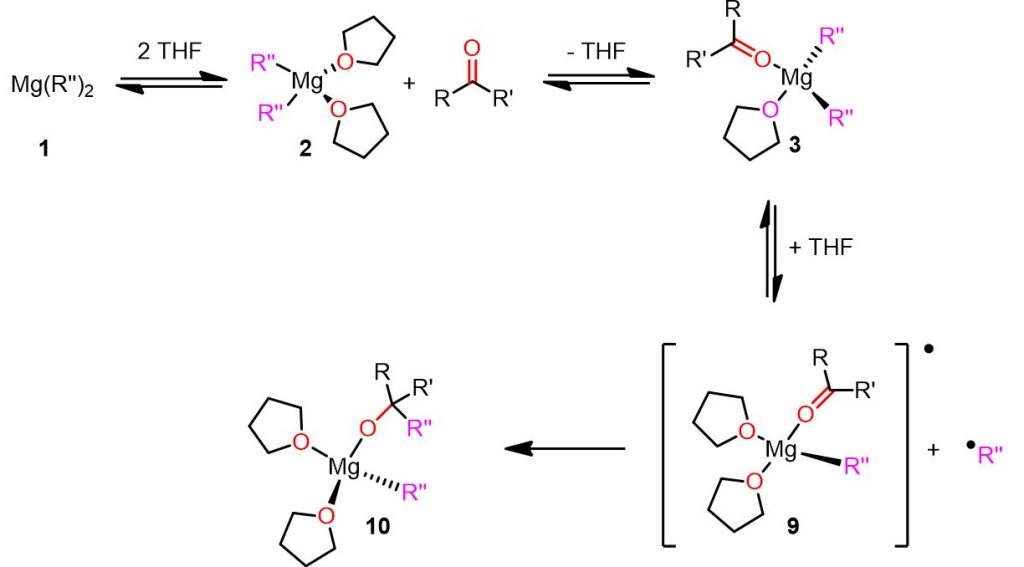
Nel meccanismo radicalico proposto, i passaggi dalla specie 1 alla 3 assomigliano al percorso nucleofilo (Figura 4) e coinvolgono la formazione di un complesso di magnesio con il substrato coordinato (vedi complesso 3). Tuttavia, nel meccanismo radicalico, uno dei legami Mg-R” subisce una rottura omolitica, con la formazione del complesso radicalico di magnesio 9 e di un frammento R” radicale. Successivamente, il frammento R” radicale reagisce con il gruppo carbonilico elettrofilo sul complesso 9 per produrre la specie 10, con il prodotto alcolato legato all’atomo di Mg.
Come abbiamo già menzionato, il meccanismo radicalico può avvenire solo con substrati che possiedono bassi potenziali di riduzione, come i composti carbonilici aromatici come il benzofenone e il fluorene. Al contrario, chetoni alchilici e aldeidi alchiliche subiranno esclusivamente il meccanismo nucleofilo.
Questo avviene perché la densità elettronica del complesso 9 con elettroni spaiati è principalmente localizzata sul gruppo carbonilico. Di conseguenza, i substrati aromatici possono delocalizzare l’elettrone non appaiato all’interno delle loro strutture attraverso la risonanza, riducendo così l’energia di dissociazione del legame Mg-R” e di conseguenza abbassando la barriera energetica per la formazione della specie radicalica 9.
Inoltre, i substrati con orbitali π vuoti a bassa energia (indicativi di basso potenziale di riduzione) sono spesso ingombranti. L’ingombro significativo di questi substrati ostacola il percorso nucleofilo, dove la flessibilità dei complessi di magnesio è cruciale per la fattibilità della reazione..
In conclusione, il percorso radicalico è favorito sia da fattori elettronici (come substrati con basso potenziale di riduzione) che da fattori sterici (nel caso di substrati ingombranti).
CONCLUSIONI
Dopo un secolo di dibattito, il meccanismo della reazione di Grignard è finalmente stato chiarito.
In particolare, abbiamo osservato che due percorsi principali sono possibili: le via radicalica e quella nucleofila.
Il meccanismo radicalico si manifesta quando la reazione di Grignard viene condotta con substrati aromatici e ingombranti. L’aromaticità stabilizza l’intermedio radicalico organomagnesio 9 attraverso la delocalizzazione degli elettroni, mentre l’ingombro sterico ostacola il percorso nucleofilo.
Al contrario, il percorso nucleofilo si verifica con aldeidi alchiliche e chetoni alchilici o con substrati aromatici che non sono ingombranti, come la benzaldeide.
Il meccanismo nucleofilo può procedere attraverso vari percorsi, a causa della formazione di numerosi composti organomagnesio in soluzione. Tuttavia, il meccanismo di reazione aderisce ai seguenti principi primari:
La reazione avviene quando sia il substrato che il nucleofilo sono all’interno della sfera di coordinazione dei centri di Mg.
Il numero di atomi di Mg nel complesso reattivo non è cruciale, poiché sia complessi mononucleari sia quelli dinucleari mostrano barriere di attivazione simili. Allo stesso modo, il substrato e il nucleofilo possono risiedere sullo stesso o su atomi di Mg vicini (meccanismo geminale o vicinale).
Il solvente dovrebbe essere considerato un reagente poiché favorisce la riorganizzazione strutturale dei complessi reattivi del Mg.
Riferimenti
1) Peltzer, R. M., Gauß, J., Eisenstein, O., & Cascella, M. (2020b). The Grignard reaction – unraveling a chemical puzzle. Journal of the American Chemical Society, 142(6), 2984–2994. https://doi.org/10.1021/jacs.9b11829.
2) Ashby, E. C., & Bowers, J. R. J. (1981). Organometallic reaction mechanisms. 17. Nature of alkyl transfer in reactions of Grignard reagents with ketones. Evidence for radical intermediates in the formation of 1,2-addition product involving tertiary and primary Grignard reagents. Journal of the American Chemical Society, 103(9), 2242–2250. https://doi.org/10.1021/ja00399a018.
3) Peltzer, R. M., Eisenstein, O., Nova, A., & Cascella, M. (2017). How solvent dynamics controls the Schlenk equilibrium of Grignard reagents: A computational study of CH3MgCl in tetrahydrofuran. the Journal of Physical Chemistry. B, 121(16), 4226–4237. https://doi.org/10.1021/acs.jpcb.7b02716